Guideline
| Download guideline |  |
 |
Anbefalinger


Evidensniveau (EL) og rekommandationsgrad (RG) for kliniske rekommandationer
Vurdering af evidensniveau (EL, 1 – 5) og rekommendationsgrad (RG, A-D) følger Centre for Evidence Based Medicine, University of Oxford
| # | Klinisk rekommandation | EL |
| Udredning | ||
| 1 | IBS diagnosen kan stilles som en positiv diagnose hos patienter, der opfylder Rom III kriterierne, har normal objektiv undersøgelse, normal CRP og hæmoglobin og fravær af alarmsymptomer | 2b |
| 2 | Patienter med IBS og diarré bør undersøges for cøliaki | 3a |
| 3 | Patienter med IBS og diarré skal ikke rutinemæssigt have undersøgt fæces for tarmpatogene parasitter | 3b |
| 4 | Patienter med IBS skal ikke rutinemæssigt have foretaget pusteprøve for bakteriel overvækst | 4 |
| 5 | Hos patienter <40 år med IBS symptomer og diarré kan en normal fæces calprotectin med stor sandsynlighed udelukke IBD | 2b |
| 6 | Laktasegentesten udføres ved bestyrket klinisk mistanke om laktosemalabsorption | 1c |
| 7 | Testbehandling med colestyramin kan forsøges hos patienter med svær IBS-D for at screene for galdesyremalabsorption | 1c |
| 8 | Endoskopi anbefales ikke rutinemæssigt i udredningen af IBS | 4 |
| Behandling | ||
| 9 | Motion 3 gange ugentligt af moderat intensitet kan hos særligt motiverede patienter reducere symptomer og øge QOL | 1a |
| 10 | Low FODMAP diæt kan forsøges hos motiverede patienter under diætistvejledning. I korttidsstudier hos selekterede patienter kan diæten formentlig reducere oppustethed og smerter og øge QOL. | 1b |
| 11 | Traditionelle diætråd (Svensk IBS diæt) kan reducere symptomerne lige så godt som low FODMAP diæt | 1c |
| 12 | Glutenfri diæt. Der er ingen klinisk relevant effekt af glutenfri diæt hos patienter med IBS | 1b |
| 13 | Probiotika er uden klinisk betydningsfuld effekt på symptomerne ved IBS | 1a |
| 14 | Psyllium kan muligvis reducere IBS symptomer (global effekt) | 1a |
| 15 | Akupunktur er ikke bedre til at reducere IBS symptomer end placebo-akupunktur | 1b |
| 16 | Loperamid kan anvendes til at nedsætte afføringsfrekvensen af IBS-D patienter | 1c |
| 17 | Ondansetron kan reducere urgency, oppustethed og afføringsfrekvens ved IBS-D (kun 1 RCT) | 1b |
| 18 | Questran har ikke effekt ved IBS-D uden galdesyremalabsorption | 4 |
| 19 | Traditionelle osmotiske (dog ikke laktulose) og stimulerende laksantia kan anvendes ved IBS-C | 5 |
| 20 | Linaclotid har effekt på obstipation og smerter ved IBS-C | 1b |
| 21 | Prucaloprid kan anvendes til obstipation ved IBS-C | 5 |
| 22 | Pebermynteolie kan reducere mavesmerter hos patienter med IBS | 1b |
| 23 | Spasmolytika af hyoscintypen kan medføre let reduktion af mavesmerter | 1a |
| 24 | Lavdosis TCA kan reducere mavesmerter hos patienter med IBS | 1a |
| 25 | SSRI har en vis ’global’ effekt ved IBS | 1a |
| 26 | Rifaximin anbefales ikke til behandling af oppustethed pga. begrænset og kortvarig effekt | 1b |
| 27 | Simeticon/dimeticon anbefales ikke, da det aldrig er testet på patienter med IBS | 5 |
Indledning
Ca. 10-16 % af voksne danskere har symptomer foreneligt med IBS [1, 2]. IBS er hyppigst i 20 til 40-årsalderen, men ses også hos børn og ældre. IBS medfører nedsat livskvalitet og påvirket social- og arbejdsliv og er omkostningstung for samfundet. Der er ingen øget dødelighed eller øget cancerrisiko ved IBS. Årsager og patogenese er uafklarede, men mulige mekanismer er bl.a. forstyrrelse af tarmens motorik og nervesystem samt dysbiose. Der er en familiær forekomst, men det er uafklaret om det er genetisk eller miljømæssigt betinget. Kvindeligt køn er en risikofaktor og IBS kan opstå efter en akut gastroenteritis (post-infektiøs IBS).
Symptomer ved IBS/klinisk billede
Patienterne klager over periodevise eller kroniske mavesmerter eller ubehag i maven og ledsagende ændringer i afføringens hyppighed eller konsistens. Mænd har i højere grad end kvinder diarré og mindre hyppigt obstipation. Smerterne kan præsentere sig som anfald, der kan fejltolkes som akut abdomen. Oppustethed er ofte et dominerende symptom. Mange patienter er generet af forstyrret defækation (urgency, øget brug af bugpresse eller følelsen af inkomplet tarmtømning). Der er et betydeligt overlap mellem IBS, funktionel dyspepsi og refluks og ekstraintestinale symptomer som træthed, urinvejssymptomer og smerter; især hovedpine, rygsmerter og dyspareuni, ses. Comorbid angst eller depression er hyppig og forværrer IBS symptomerne. IBS er associeret til kronisk træthedssyndrom og bodily distress syndrome.
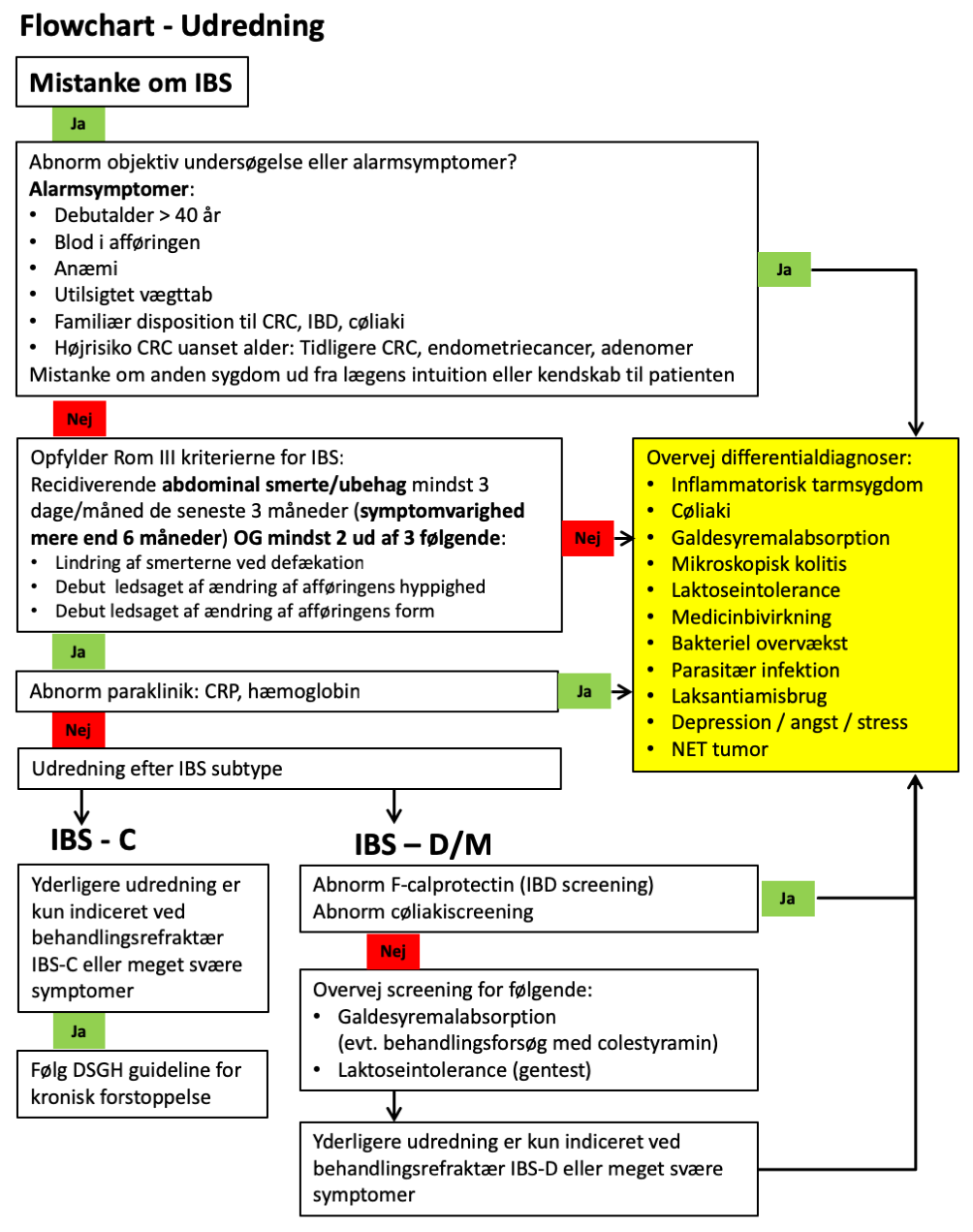
Hvordan stilles diagnosen IBS?

Diagnosen stilles positivt på baggrund af genkendelse af det velbeskrevne syndrom ved hjælp af symptombaserede kriterier og udelukkelse af organisk sygdom. Organisk sygdom udelukkes ved evaluering af alarmsymptomer, objektiv undersøgelse og et paraklinisk udredningsprogram. Der er ingen biomarkører for IBS. En positiv diagnostisk strategi er i primærsektoren i Danmark vist at være ligeværdig med traditionel eksklusionsdiagnostik inkluderende blodprøver og sigmoideoskopi i forhold til sikkerhed, patienttilfredshed og omkostninger [4].
Symptombaserede kriterier for IBS
Aktuelt anvendes Rom III kriterierne for IBS. Flere systematiske reviews og metaanalyser viser dog at de forskellige symptombaserede kriterier (Manning kriterierne, Rom I og II) kan anvendes ligeværdigt [5, 6]. Sensitiviteten af Rom III kriterierne er i almen praksis i Danmark estimeret til 76 % [7]. I gastroenterologisk ambulatorium i Canada måltes sensitiviteten til 69 %, specificiteten til 80 % [5]. En del af patienterne opfylder ikke strikte Rom III kriterierne, men IBS diagnosen kan stilles på de typiske symptomer og fravær af organisk sygdom. IBS symptomerne fluktuerer og patienter, der på et tidspunkt opfylder kriterierne for IBS, gør det ikke nødvendigvis senere. Klinikeren bør ikke af den grund betvivle diagnosen og iværksætte udredning med mindre symptomerne er væsentligt ændret eller der er opstået alarmsymptomer.
Alarmsymptomer
Alarmsymptomer, der indicerer en grundigere udredning, er familiær disposition til CRC og IBD, vægttab, rektal blødning, anæmi og abnorme fund ved objektiv undersøgelse. Alle patienter med debut af IBS symptomer efter 40-årsalder og patienter i højrisiko for CRC (tidligere CRC, adenomer eller endometriecancer, IBD eller familiær disposition til HNPCC eller FAP) uanset alder udredes i henhold til de nationale retningslinjer for CRC (http://www.dccg.dk/03_Publikation/01_ret.html). I henhold til DSGH’s retningslinje for cøliaki (http://www.dsgh.dk/home/guidelines) bør patienter med 1. grads slægtninge med cøliaki udredes herfor.
Objektiv og paraklinisk undersøgelse
En grundig objektiv undersøgelse samt et minimalt paraklinisk udredningsprogram (hæmoglobin og CRP) tjener formålet at udelukke organisk sygdom. Der er international konsensus om at patienter > 45 år (Danmark: > 40 år) bør tilbydes nedre skopi af hensyn til den højere risiko for CRC. Derudover skal udredningen følge IBS subtype. Der er ikke evidens for rutinemæssigt at tage sænkningsreaktion (SR), thyreoideastatus eller UL af abdomen [8]. Der foreligger ingen studier af værdien af MR tyndtarm, tyndtarmspassage eller kapselendoskopi hos patienter med formodet IBS.
Udredning af IBS-D og IBS-M
De vigtigste differentialdiagnoser til IBS, hvor diarré er dominerende, er cøliaki, IBD, mikroskopisk colitis, galdesyremalabsorption, bakteriel overvækst, giardiasis, laktosemalabsorption og CRC. For patienter, der opfylder symptombaserede kriterier for IBS og er uden alarmsymptomer, er sandsynligheden for organisk lidelse formentlig < 15 % i sekundærsektoren [5, 9]
Cøliaki
Test for cøliaki er vist omkostningseffektiv ved en prævalens af cøliaki over 1 % [10, 11]. Det er fortsat uafklaret om prævalensen hos danske IBS patienter uden alarmsignaler er tilsvarende eller højere end de 0.5-1 %, der ses i baggrundsbefolkningen. Da serologiske tests for cøliaki er tilgængelige og billige, bør testen tilbydes til patienter, der præsenterer sig med diarré (IBS-D og IBS-M).
Fæces calprotectin
Fæces calprotectin (F-Cal) kan anvendes i stedet for CRP til screening for IBD, idet både sensitivitet og specificitet er højere end for CRP og testen er vist at skelne IBD fra IBS med en høj negativ prædiktiv værdi i populationer med en IBD prævalens under 25 % [12, 13]. En F-Cal < 50 µg/g, som er det hyppigst anvendte cut-off i Danmark, reducerer sandsynligheden for at symptomerne skyldes IBD til 1,3 %. Disse patienter skal kun endoskoperes, såfremt IBS ikke er den primære mistanke. Udredning for IBD bør overvejes hos patienter med F-Cal > 50 µg/g. Det skal dog bemærkes, at der er et overlap mellem IBS og IBD især i området 50-200 µg/g ligesom andre inflammatoriske tilstande i tarmen kan medføre forhøjet F-Cal. Omkostnings-effektiviteten er ikke kendt i sekundærsektoren, men i primærsektoren i UK er testen vist at spare endoskopier, hvor mistanken er IBS [14] . Såfremt endoskopi er planlagt, er F-Cal overflødig.
Fæces parasitter
Der er ikke evidens for at tarmparasitter er hyppigere hos patienter med IBS i forhold til raske kontroller i Danmark, snarere tværtimod [15], og fæces undersøgelse for tarmpatogene parasitter er derfor ikke rutinemæssigt indiceret.
Pusteprøve for bakteriel overvækst
Litteraturen på forekomsten af bakteriel overvækst i tyndtarmen hos patienter, der opfylder symptombaserede kriterier for IBS, er præget af stor heterogenitet [16]. Sådanne undersøgelser bør derfor ikke indgå rutinemæssigt i udredningen.
Laktasemangel
Laktosemalabsorption verificeret ved pusteprøve ses med lige stor hyppighed ved IBS som i den generelle befolkning [17]. Imidlertid rapporterer IBS patienter flere symptomer ved indtagelse af laktoseprodukter end kontroller med laktosemalabsorption [17, 18]. Engelske og svenske guidelines anbefaler derfor eksklusion og reintroduktion af mejeriprodukter ved mistanke om laktoseintolerance frem for diagnostik af laktasemangel. I Danmark har laktasegentesten fortsat sin berettigelse ved bestyrket klinisk mistanke.
Galdesyremalabsorption
Der en høj forekomst (~ 25 %) af galdesyremalabsorption hos patienter med IBS-D symptomer [19, 20]. Behandling med colestyramin har dog kun effekt på galdesyremalabsorptionen - og derved diareen - men ikke på de øvrige IBS symptomer [21]. Ved mistænkt galdesyremalabsorption anvendes en testperiode med colestyramin og, såfremt der findes effekt, kan der foretages SeHCAT scanning med henblik på verificering.
Endoskopi
Koloskopi hos patienter med mistanke om IBS-D kan udføres for at udelukke CRC, og IBD. Der er ikke evidens som kan støtte rutinemæssig koloskopi hos IBS-D eller IBS-M patienter < 40 år uden alarmsymptomer [22, 23].
Udredning af IBS-C
Der er ikke evidens for yderligere udredning af patienten med IBS-C uden alarmtegn, medmindre patienten er behandlingsrefraktær eller har meget svære symptomer. I så fald henvises til DSGH guideline for kronisk forstoppelse (www.dsgh.dk/home/guidelines).
Kliniske rekommandationer om udredning på mistanke om IBS
|
Rekommandation |
EL |
|
IBS diagnosen kan stilles som en positiv diagnose hos patienter, der opfylder Rom III kriterierne, har normal objektiv undersøgelse, normal CRP og hæmoglobin og fravær af alarmsymptomer |
2B |
|
Patienter med IBS og diarré bør undersøges for cøliaki |
3a |
|
Patienter med IBS og diarré skal ikke rutinemæssigt have undersøgt fæces for tarmpatogene parasitter |
3b |
|
Patienter med IBS og diarré skal ikke rutinemæssigt have foretaget pusteprøve for bakteriel overvækst |
4 |
|
Hos patienter <40 år med IBS symptomer og diarré kan en normal fæces calprotectin med stor sandsynlighed udelukke IBD |
2b |
|
Laktasegentesten udføres ved bestyrket klinisk mistanke om laktosemalabsorption |
1c |
|
Testbehandling med colestyramin kan forsøges hos patienter med svær IBS-D for at screene for galdesyremalabsorption |
1c |
|
Endoskopi anbefales ikke rutinemæssigt i udredningen af IBS |
4 |
Hvordan behandles IBS?

Behandlingseffekten er generelt lav og højest sandsynligt overvurderet i de ældre studier. Imidlertid er bivirkningerne generelt milde og den mulige symptomatiske effekt relativt stor, hvilket kan berettige behandlingsforsøg. Behandlingsvalg baseret på IBS subtyper er pragmatisk ud fra klinisk erfaring og der foreligger endnu kun få studier. Særligt er betydningen af tidligere svigt med andet præparat uklar. Der er generelt ikke langtidsstudier på IBS behandling. Generaliserbarheden af studierne er dårlig, bl.a. på grund af stærk selektion.
Nonfarmakologisk behandling
Motion er undersøgt i to randomiserede forsøg med i alt 158 patienter [24, 25]. Begge forsøg viste effekt på symptomer og livskvalitet, men der var betydelig selektion og et vist frafald undervejs.
Probiotika. Mere end 50 randomiserede forsøg har testet den symptomatiske effekt af forskellige blandinger og doser af probiotika. Forskelle i design og i interventionens karakter vanskeliggør evaluering med meta-analyser. De fleste af de 27 studier med blandinger af probiotika viste ingen effekt. Studier på danske patienter har ikke vist effekt. Hovedparten af studierne med lactobaciller og Saccharomyces var ligeledes negative mens 4 af 6 forsøg med bifidobacterier viste positive resultater (global effekt). Samlet set er der meget begrænset evidens for symptomatisk effekt af probiotika [26].
Low FODMAP diæt. LFD er ikke godt nok undersøgt til at en evt. effekt kan estimeres [27]. Fem af seks RCT, hvoraf kun to dobbeltblindede og med studievarigheder fra 2 dage til 4 uger, rapporterede symptomatisk effekt men ingen effekter i objektive mål (afføringsfrekvens/konsistens). Der er ingen langtidsstudier (>4 uger) eller studier af effekten under den anbefalede re-introduktionsperiode. LFD kan reducere IBS symptomerne med ca. 20 % og giver ca. 50 % respondere (50 point reduktion på IBS-SSS) inkl. placeboeffekt.
Traditionelle IBS diætråd. ”Svensk IBS diæt” er mindre indgribende og kan reducere symptomerne lige så godt som LFD (LFD: 22 % symptomreduktion og 50 % respondere vs. 24 % symptomreduktion og 46 % respondere). Der var ikke placebogruppe i studiet, som havde varighed på 4 uger [28].
Glutenfri diæt. Glutenfri diæt har ikke effekt hos IBS patienter. Patienter på LFD får samme øgning i IBS symptomer når de får at vide at de enten får et blindet glutenholdigt testmåltid eller placebo. Symptomøgningen er lige høj uanset om der er meget gluten, lidt gluten eller ingen gluten i testmåltidet [29]. Et randomiseret forsøg af glutenfri diæt til IBS-D patienter viste en klinisk insignifikant effekt (0.25 færre afføringer pr. dag) [30].
Psyllium (loppefrøskaller, HUSK). En meta-analyse baseret på seks forsøg viste heterogenitet og flere symptomfri patienter i den aktive gruppe (terapeutisk gevinst 12%). Denne effekt var ikke længere statistisk signifikant, hvis et lavkvalitetsstudie blev udeladt af analysen [31]. Det er aldrig undersøgt om tilsætning af kalk til psyllium (HUSK med kalk) har effekt på diarré hos IBS patienter.
Akupunktur virker ved placeboeffekt. Akupunktur er undersøgt i flere veldesignede RTC med placebo-akupunktur [32], hvoraf det største randomiserede 230 patienter [33]. Akupunktur og placebo-akupunktur reducerede symptomerne lige effektivt.
Farmakologisk behandling af diarré

Loperamid reducerer afføringsfrekvensen ved IBS-D. Loperamid er undersøgt i flere ældre lavkvalitetsstudier og i et godt RCT med 90 patienter [34]. Den terapeutiske gevinst (reduktion i afføringsfrekvens) var 30 % (40 % i loperamidgruppen vs. 10 % i placebogruppen). Der var ingen signifikant effekt på smerter eller oppustethed.
Ondansetron er undersøgt i et placebokontrolleret overkrydsningsforsøg med 120 IBS-D patienter [35]. Ondansetron havde effekt på afføringsfrekvens, urgency og oppustethed, men ikke på smerter.
Colestyramin Ved mistanke om galdesyremalabsorption kan præparatet anvendes som diagnostisk test (se ovenfor) forud for evt. SeHCAT-skanning. I selekterede materialer fra sekundærsektoren har 10 – 33 % af IBS-D patienter tegn på galdesyremalabsorption med patologisk se-HCAT (< 15 % retention) [36] og har på den baggrund effekt af colestyramin. IBS-D patienter med normal se-HCAT eller mild galdesyremalabsorption (10-15 % retention) har ikke effekt af colestyramin. Effekten på IBS-D uden samtidig galdesyremalabsorption er dog ikke undersøgt i store RCT [23].
Farmakologisk behandling af obstipation
Se Tabel 1
Laksantia.
Effekten af polyethylenglycol (PEG) er testet i et placebo-kontrolleret forsøg med 139 patienter. Der var effekt på obstipationen men ikke på smerter [37]. Der findes ingen RCT af effekten af øvrige konventionelle laksantia på IBS-C. Der er et stort overlap mellem kronisk obstipation og IBS-C. Generelt for kronisk forstoppelse er anbefalingerne at starte med osmotisk virkende laksantia (magnesia eller PEG) og supplere med peristaltikfremmende laksantia og denne fremgangsmåde kan også anbefales ved IBS-C. Laktulose har effekt på obstipation, men har flere bivirkninger end de andre osmotiske laksantia, hvorfor præparatet ikke anbefales.
Linaclotid. To amerikanske RCT med > 1600 patienter har vist effekt på antal afføringer, smerter og oppustethed. Effekten på forstoppelsen indtræder indenfor få uger mens effekten på smerter og oppustethed kommer senere (uger – måneder). Den terapeutiske gevinst over for placebo (sammensat endpoint) er i størrelsesordenen 12-15 % [38].
Prucaloprid. Er indregistreret til kronisk obstipation, men kan forsøges ved IBS-C.
Farmakologisk behandling af smerter
Se tabel 1
Pebermynteolie. RCT er få, gamle og med lavt deltagerantal (∑N=357). Til trods herfor er der ved metaanalyser enighed om terapeutisk gevinst [39, 40]. Bivirkninger er sjældne, hyppigst halsbrand, der kan undgås ved at indtage olien i kapselform.
Spasmolytika. Et Cochrane review af 13 RCT (∑N=1392) indeholdt studier af 10 forskellige farmakologiske undergrupper [40]. Kun få af præparaterne er tilgængelige i Danmark. Der var en terapeutisk gevinst sammenlignet med placebo på 12 % (58 % vs. 46 %). Et systematisk review [31] undersøgte effekten af 12 forskellige spasmolytika. Af disse er kun mebeverin (Duspatalin®) og hyoscin (Buscopan®) markedsført i Danmark. Der fandtes ingen effekt af mebeverin (1 RCT med 80 patienter) mens 3 RCT (426 patienter) med hyoscin viste en terapeutisk gevinst på 17%. Der var dog tegn på heterogenitet og risiko for publikationsbias.
Antidepressiva. En meta-analyse fra 2014 konkluderer ud fra 7 RCT (∑N=384) en samlet relativ risiko for vedblivende mavesmerter på 0.62 (95% CI 0.43-0.88). Ved subgruppering sås betydende heterogenicitet blandt SSRI-studierne, men ikke TCA-studierne [41]. Seneste Cochrane review finder SSRI og TCA ligeværdige i behandlingen af IBS, idet SSRI har en signifikant ”global” effekt, men ingen effekt på smerterne [40]. Præparatvalg bør afhænge af patientens IBS subtype, idet TCA kan give forstoppelse mens SSRI kan give diarré. For at reducere risikoen for bivirkninger anbefales lavdosis TCA og laveste normal dosis SSRI [23] (se tabel 1).
Farmakologisk behandling af oppustethed
Se tabel 1
Rifaximin er undersøgt i to store RCT (∑N > 1200 patienter) med IBS-D og IBS-M. Rifaximin anbefales ikke da den terapeutisk gevinst for oppustethed er på højst 10% og der ofte kræves gentagne kure for at holde symptomerne i ro (terapeutisk gevinst for genbehandling nr. 2 og 3 begge på 8 %) [42, 43].
Simeticon. Effekten af simeticon (aktiveret dimeticon) er vanskelig at bedømme da præparatet kun er undersøgt i kombination med andre stoffer til IBS patienter.
Psykologisk behandling
For patienter, hvor ovenstående behandling ikke har haft tilstrækkelig effekt, kan næste skridt være psykoterapi, kognitiv terapi, relaksation, hypnose. Der findes flere metaanalyser og der er generelt positiv effekt af metoderne til trods for at det har været de sygeste patienter, der er indgået [41, 44, 45]. Generelt er studierne små, af kort varighed og forskellig kvalitet. Særligt mangler effektiv blinding. I Danmark er der ingen tilskud til ovenstående behandlinger ved IBS. Ydermere kan ingen centre i Danmark aktuelt tilbyde behandlingerne og patienterne må selv opsøge terapeuter.
Kliniske rekommandationer om behandling af IBS
|
Rekommandation |
EL |
|
|
Motion |
Motion 3 gange ugentligt af moderat intensitet kan hos særligt motiverede patienter reducere symptomer og øge QOL |
1b |
|
Diæt |
Low FODMAP diæt kan forsøges hos motiverede patienter under diætistvejledning. I korttidsstudier hos selekterede patienter kan diæten formentlig reducere oppustethed og smerter og øge QOL. |
1b |
|
Traditionelle diætråd kan reducere symptomerne lige så godt som low FODMAP diæt |
1c |
|
|
Glutenfri diæt. Der er ingen klinisk relevant effekt af glutenfri diæt hos patienter med IBS |
1b |
|
|
Probiotika er uden klinisk betydningsfuld effekt på symptomerne ved IBS |
1a |
|
|
Psyllium kan muligvis reducere IBS symptomer (global effekt) |
1a |
|
|
Akupunktur er ikke bedre til at reducere IBS symptomer end placebo-akupunktur |
1b |
|
|
Diarré |
||
|
Loperamid kan nedsætte afføringsfrekvensen ved IBS-D |
1c |
|
|
Ondansetron kan reducere urgency, oppustethed og afføringsfrekvens ved IBS-D (kun 1 RCT) |
1b |
|
|
Questran har ikke effekt ved IBS-D uden galdesyremalabsorption |
4 |
|
|
Obstipation |
||
|
Traditionelle osmotiske (dog ikke laktulose) og stimulerende laksantia kan anvendes ved IBS-C |
5 |
|
|
Magnesia kan anvendes til obstipation ved IBS-C |
5 |
|
|
PEG kan anvendes til obstipation ved IBS-C |
5 |
|
|
Laktulose bør ikke anvendes til obstipation ved IBS-C |
5 |
|
|
Bisacodyl kan anvendes til obstipation ved IBS-C |
5 |
|
|
Natrium picosulfat kan anvendes til obstipation ved IBS-C |
5 |
|
|
Linaclotid har effekt på obstipation og smerter ved IBS-C |
1b |
|
|
Prucaloprid kan anvendes til obstipation ved IBS-C |
5 |
|
|
Smerter |
Pebermynteolie kan reducere mavesmerter ved IBS |
1b |
|
Spasmolytika af hyoscintypen kan medføre let reduktion af mavesmerter |
1a |
|
|
Lavdosis TCA kan reducere mavesmerter |
1a |
|
|
SSRI har en vis ’global’ effekt ved IBS |
1a |
|
|
Oppustethed |
|
|
|
Rifaximin anbefales ikke til behandling af oppustethed pga. begrænset og kortvarig effekt |
1b |
|
|
Simeticon/dimeticon anbefales ikke, da det aldrig er testet på patienter med IBS |
5 |
Patientvejledninger
Lang patientvejledning (6 sider) – indsæt link
Kort patientvejledning (2 sider) – indsæt link
Forfattere og korrespondance
Anders Bak-Christensen, Peter Bytzer (tovholder), Anne Line Engsbro, Janne Fassov, Lotte Fynne, Anne Lund Krarup
Korrespondance:
Professor, overlæge, ph.d. Peter Bytzer, Medicinsk afdeling, Køge Sygehus, Lykkebækvej 1, 4600 Køge
Status
| Første udkast | maj 2016 |
| Diskuteret til Aarsmødet | aug 2016 |
| Korrigeret udkast | okt 2010 |
| Endelig guideline | okt 2016 |
| Guideline skal revideres senest | okt 2020 |
Afgrænsning af emnet
Retningslinjen omfatter udredning og behandling af colon irritabile (IBS) hos voksne i gastroenterologisk speciallægepraksis, ambulatorium og hospitalsafdeling.
Definitioner
IBS er et syndrom, der karakteriseres ved tilbagevendende ubehag eller smerte i maven ledsaget af ændret afføringsmønster. I denne guideline anvendes Rom III kriterierne [3]:
Recidiverende abdominal smerte eller ubehag mindst 3 dage om måneden i de seneste 3 måneder og mindst 2 af 3 følgende:
- Lindring af smerter/ubehag ved defækation
- Debut ledsaget af ændring i afføringens hyppighed
- Debut ledsaget af ændring i afføringens form
Symptomvarighed ≥ 6 måneder.
IBS subtyper
- IBS-C: Hård eller knoldet afføring* ≥ 25 % af tiden og løs eller vandig afføring** < 25 % af tiden
- IBS-D: løs eller vandig afføring ≥ 25 % af tiden og hård eller vandig afføring < 25 % af tiden
- IBS-M: Hård eller knoldet afføring ≥ 25 % af tiden og løs eller vandig afføring ≥ 25 % af tiden
- IBS-U: Hård eller knoldet afføring < 25 % af tiden og løs eller vandig afføring < 25 % af tiden
*Hård eller knoldet afføring: svarende til BSSF 1-2
**Løs eller vandig afføring: svarende til BSSF 6-7
Forkortelser
BSSF: Bristol Stool Form Scale, CRC: kolorektal cancer, CRP: C-reaktivt protein, FAP: Familiær adenomatøs polypose, F-Cal: Fæces calprotectin, HNPCC: Heriditær non-polypøs kolorektal cancer, IBD: Inflammatorisk tarmsygdom, IBS: Colon irritabile (irritabel tyktarm, Irritable Bowel Syndrome), IBS-SSS: IBS Symptom Severity Scale, LFD: Low FODMAP diæt, PEG: Polyethylenglycol, QOL: Quality of life, RCT: Randomised controlled trial, SSRI: Selektiv serotonin reuptake inhibitor, TCA: Tricyklisk antidepressivum, UL: Ultralyd
Litteratur søgning
Litteratursøgning i Pubmed er afsluttet februar 2016.
MESH-termer ”Irritable bowel syndrom” fra 2004, ”colonic diseases, functional fra 1970-2003 og fritekstsøgning på ”Irritable bowel syndrome”. Derudover er der søgt ud fra referencelister fra reviews og nationale guidelines fra Europa og USA. EMBASE er søgt for studier, der kun er publiceret i abstract form.
Interessekonflikter
Ej angivet
Referencer
(1) Guevara M, Cardenas A, Ginés P. Prognosis of patients with cirrhosis and ascites. In: Ginés P, Arroyo V, Rodes J, Schrier RW, editors. Ascites and renal dysfunction in liver disease. ed. Malden: Blackwell; 2005. p. 260-270.
(2) Gines P, Cardenas A. The management of ascites and hyponatremia in cirrhosis. Semin Liver Dis 2008;28(1):43-58.
(3) Møller S, Henriksen JH. The systemic circulation in cirrhosis. In: Gines P, Arroyo V, Rodes J, Schrier RW, editors. Ascites and renal dysfunction in liver disease. 2nd ed. Malden: Blackwell; 2005. p. 139-155.
(4) Ripoll C, Groszmann R, Garcia-Tsao G, Grace N, Burroughs A, Planas R et al. Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis. Gastroenterology 2007;133(2):481-488.
(5) Gines P, Guevara M. Hyponatremia in cirrhosis: pathogenesis, clinical significance, and management. Hepatology 2008;48(3):1002-1010.
(6) Møller S, Henriksen JH, Bendtsen F. Ascites: Pathogenesis and therapeutic principles. Scand J Gastroenterol 2009:902-911.
(7) Angeli P, Merkel C. Pathogenesis and management of hepatorenal syndrome in patients with cirrhosis. J Hepatol 2008;48(Suppl.1):S93-S103.
(8) Wong F, Bernardi M, Balk R, Christman B, Moreau R, Garcia-Tsao G et al. Sepsis in cirrhosis: report on the 7th meeting of the International Ascites Club. Gut 2005;54(5):718-725.
(9) Khan J, Pikkarainen P, Karvonen AL, Makela T, Peraaho M, Pehkonen E et al. Ascites: Aetiology, mortality and the prevalence of spontaneous bacterial peritonitis. Scand J Gastroenterol 2009;1-5.
(10) Moore KP, Wong F, Gines P, Bernardi M, Ochs A, Salerno F et al. The management of ascites in cirrhosis: Report on the consensus conference of the International Ascites Club. Hepatology 2003;38(1):258-266.
(11) Schrier RW. Decreased effective blood volume in edematous disorders: what does this mean? J Am Soc Nephrol 2007;18(7):2028-2031.
(12) Bernardi M, Domenicali M. The renin-angiotensin-aldosterone system in cirrhosis. In: Ginés P, Arroyo V, Rodes J, Schrier RW, editors. Ascites and renal dysfunction in liver disease. 2nd ed. Malden: Blackwell Pullishing Ltd; 2005. p. 43-54.
(13) Dudley FJ, Esler M. The sympathetic nervous system in cirrhosis. In: Ginés P, Arroyo V, Rodes J, Schrier RW, editors. Ascites and renal dysfunction in liver disease. 2nd ed. Malden: Blackwell Publishing Ltd; 2005. p. 54-72.
(14) Henriksen JH, Møller S. Alterations of hepatic and splanchnic microvascular exchange in cirrhosis: Local factors in the formation of ascites. In: Gines P, Arroyo V, Rodes J, Schrier RW, editors. Ascites and renal dysfunction in liver disease. 2nd ed. Malden: Blackwell; 2005. p. 174-185.
(15) Runyon BA. Management of adult patients with ascites due to cirrhosis: An update. Hepatology 2009;49(6):2087-2107.
(16) Gatta A, Angeli P, Caregaro L, Menon F, Sacerdoti D, Merkel C. A pathophysiological interpretation of unresponsiveness to spironolactone in a stepped-care approach to the diuretic treatment of ascites in nonazotemic cirrhotic patients. Hepatology 1991;14(2):231-236.
(17) Bernardi M, Laffi G, Salvagnini M, Azzena G, Bonato S, Marra F et al. Efficacy and safety of the stepped care medical treatment of ascites in liver cirrhosis: a randomized controlled clinical trial comparing two diets with different sodium content. Liver 1993;13(3):156-162.
(18) Angeli P, Gatta A, Caregaro L, Menon F, Sacerdoti D, Merkel C et al. Tubular site of renal sodium retention in ascitic liver cirrhosis evaluated by lithium clearance. Eur J Clin Invest 1990;20(1):111-117.
(19) Angeli P, De Bei E, Dalla PM, Caregaro L, Ceolotto G, Albino G et al. Effects of amiloride on renal lithium handling in nonazotemic ascitic cirrhotic patients with avid sodium retention. Hepatology 1992;15(4):651-654.
(20) Moore KP, Aithal GP. Guidelines on the management of ascites in cirrhosis. Gut 2006;55 Suppl 6:vi1-vi12.
(21) Marchesini G, Bianchi G, Amodio P, Salerno F, Merli M, Panella C et al. Factors associated with poor health-related quality of life of patients with cirrhosis. Gastroenterology 2001;120(1):170-178.
(22) Angeli P, Albino G, Carraro P, Dalla PM, Merkel C, Caregaro L et al. Cirrhosis and muscle cramps: evidence of a causal relationship. Hepatology 1996;23(2):264-273.
(23) Fernandez-Esparrach G, Guevara M, Sort P, Pardo A, Jimenez W, Gines P et al. Diuretic requirements after therapeutic paracentesis in non-azotemic patients with cirrhosis. A randomized double-blind trial of spironolactone versus placebo. J Hepatol 1997;26(3):614-620.
(24) Sola R, Andreu M, Coll S, Vila MC, Oliver MI, Arroyo V. Spontaneous bacterial peritonitis in cirrhotic patients treated using paracentesis or diuretics: results of a randomized study. Hepatology 1995;21(2):340-344.
(25) Lin CH, Shih FY, Ma MH, Chiang WC, Yang CW, Ko PC. Should bleeding tendency deter abdominal paracentesis? Dig Liver Dis 2005;37(12):946-951.
(26) Webster ST, Brown KL, Lucey MR, Nostrant TT. Hemorrhagic complications of large volume abdominal paracentesis. Am J Gastroenterol 1996;91(2):366-368.
(27) Gines A, Fernandez-Esparrach G, Monescillo A, Vila C, Domenech E, Abecasis R et al. Randomized trial comparing albumin, dextran 70, and polygeline in cirrhotic patients with ascites treated by paracentesis. Gastroenterology 1996;111:1002-1010.
(28) Pozzi M, Osculati G, Boari G, Serboli P, Colombo P, Lambrughi C et al. Time course of circulatory and humoral effects of rapid total paracentesis in cirrhotic patients with tense, refractory ascites. Gastroenterology 1994;106(3):709-719.
(29) Vila MC, Sola R, Molina L, Andreu M, Coll S, Gana J et al. Hemodynamic changes in patients developing effective hypovolemia after total paracentesis. J Hepatol 1998;28:639-645.
(30) Moreau R, Asselah T, Condat B, de Kerguenec C, Pessione F, Bernard B et al. Comparison of the effect of terlipressin and albumin on arterial blood volume in patients with cirrhosis and tense ascites treated by paracentesis: a randomised pilot study. Gut 2002;50(1):90-94.
(31) Moreau R, Valla DC, Durand-Zaleski I, Bronowicki JP, Durand F, Chaput JC et al. Comparison of outcome in patients with cirrhosis and ascites following treatment with albumin or a synthetic colloid: a randomised controlled pilot trail. Liver Int 2006;26(1):46-54.
(32) Cardenas A, Arroyo V. Refractory ascites. Dig Dis 2005;23(1):30-38.
(33) Guardiola J, Baliellas C, Xiol X, Fernandez EG, Gines P, Ventura P et al. External validation of a prognostic model for predicting survival of cirrhotic patients with refractory ascites. Am J Gastroenterol 2002;97(9):2374-2378.
(34) Moreau R, Delegue P, Pessione F, Hillaire S, Durand F, Lebrec D et al. Clinical characteristics and outcome of patients with cirrhosis and refractory ascites. Liver Int 2004;24(5):457-464.
(35) Serste T, Melot C, Francoz C, Durand F, Rautou PE, Valla D et al. Deleterious effects of beta-blockers on survival in patients with cirrhosis and refractory ascites. Hepatology 2010;52:1017-1022.
(36) Serste T, Francoz C, Durand F, Rautou PE, Melot C, Valla D et al. Beta-blockers cause paracentesis-induced circulatory dysfunction in patients with cirrhosis and refractory ascites: A cross-over study. J Hepatol 2011;55:794-799.
(37) Bang UC, Benfield T, Hyldstrup L, Jensen JE, Bendtsen F. Effect of propranolol on survival in patients with decompensated cirrhosis: a nationwide study based Danish patient registers. Liver Int 2016;36(9):1304-1312.
(38) Reiberger T, Mandorfer M. Beta adrenergic blockade and decompensated cirrhosis. J Hepatol 2017;66(4):849-859.
(39) Sanyal AJ, Genning C, Reddy KR, Wong F, Kowdley KV, Benner K et al. The North American Study for the treatment of refractory ascites. Gastroenterology 2003;124(3):634-641.
(40) Salerno F, Merli M, Riggio O, Cazzaniga M, Valeriano V, Pozzi M et al. Randomized controlled study of TIPS versus paracentesis plus albumin in cirrhosis with severe ascites. Hepatology 2004;40(3):629-635.
(41) Gines P, Uriz J, Calahorra B, Garcia-Tsao G, Kamath PS, del Arbol LR et al. Transjugular intrahepatic portosystemic shunting versus paracentesis plus albumin for refractory ascites in cirrhosis. Gastroenterology 2002;123(6):1839-1847.
(42) Saab S, Nieto JM, Lewis SK, Runyon BA. TIPS versus paracentesis for cirrhotic patients with refractory ascites. Cochrane Database Syst Rev 2006;(4):CD004889.
(43) Salerno F, Camma C, Enea M, Rossle M, Wong F. Transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis of individual patient data. Gastroenterology 2007;133(3):825-834.
(44) Bureau C, Thabut D, Oberti F, Dharancy S, Carbonell N, Bouvier A et al. Transjugular Intrahepatic portosystemic shunts with covered stents increase transplant-free survival of patients with cirrhosis and recurrent ascites. Gastroenterology 2017;152(1)(157):163.
(45) D'amico G, Luca A, Morabito A, Miraglia R, D'Amico M. Uncovered transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis. Gastroenterology 2005;129(4):1282-1293.
(46) Wiest R, Garcia-Tsao G. Bacterial translocation (BT) in cirrhosis. Hepatology 2005;41(3):422-433.
(47) Guarner C, Soriano G. Bacterial translocation and its consequences in patients with cirrhosis. Eur J Gastroenterol Hepatol 2005;17(1):27-31.
(48) Borzio M, Salerno F, Piantoni L, Cazzaniga M, Angeli P, Bissoli F et al. Bacterial infection in patients with advanced cirrhosis: a multicentre prospective study. Dig Liver Dis 2001;33(1):41-48.
(49) Felisart J, Rimola A, Arroyo V, Perez-Ayuso RM, Quintero E, Gines P et al. Cefotaxime is more effective than is ampicillin-tobramycin in cirrhotics with severe infections. Hepatology 1985;5(3):457-462.
(50) Sort P, Navasa M, Arroyo V, Aldeguer X, Planas R, Ruizdelarbol L et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999;341(6):403-409.
(51) Andreu M, Sola R, Sitges-Serra A, Alia C, Gallen M, Vila MC et al. Risk factors for spontaneous bacterial peritonitis in cirrhotic patients with ascites. Gastroenterology 1993;104(4):1133-1138.
(52) Terg R, Fassio E, Guevara M, Cartier M, Longo C, Lucero R et al. Ciprofloxacin in primary prophylaxis of spontaneous bacterial peritonitis: a randomized, placebo-controlled study. J Hepatol 2008;48(5):774-779.
(53) Gines P, Rimola A, Planas R, Vargas V, Marco F, Almela M et al. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: results of a double-blind, placebo-controlled trial. Hepatology 1990;12(4 Pt 1):716-724.
(54) Arroyo V, Fernandez J. Management of hepatorenal syndrome in patients with cirrhosis. Nat Rev Nephrol 2011;7(9):517-526.
(55) Mehta RL, Kellum JA, Shah SV, Molitoris BA, Ronco C, Warnock DG et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007;11(2):R31.
(56) Cruz DN, Bagshaw SM, Maisel A, Lewington A, Thadhani R, Chakravarthi R et al. Use of biomarkers to assess prognosis and guide management of patients with acute kidney injury. Contrib Nephrol 2013;182:45-64. doi: 10.1159/000349965. Epub;%2013 May 13.:45-64.
(57) Fagundes C, Barreto R, Guevara M, Garcia E, Sola E, Rodriguez E et al. A Modified acute kidney injury classification for diagnosis and risk stratification of impairment of kidney function in cirrhosis. J Hepatol 2013;(3):474-481.
(58) Piano S, Rosi S, Maresio G, Fasolato S, Cavallin M, Romano A et al. Evaluation of the acute kidney injury network criteria in hospitalized patients with cirrhosis and ascites. J Hepatol 2013;(3):482-489.
(59) Wong F, Angeli P. New diagnostic criteria and management of acute kidney injury. J Hepatol 2017;66(4):860-861.
(60) Terra C, Guevara M, Torre A, Gilabert R, Fernandez J, Martin-Llahi M et al. Renal failure in patients with cirrhosis and sepsis unrelated to spontaneous bacterial peritonitis: Value of MELD score. Gastroenterology 2005;129(6):1944-1953.
(61) Angeli P, Tonon M, Pilutti C, Morando F, Piano S. Sepsis-induced acute kidney injury in patients with cirrhosis. Hepatol Int 2016;10(1):115-123.
(62) Thabut D, Massard J, Gangloff A, Carbonell N, Francoz C, Nguyen-Khac E et al. Model for end-stage liver disease score and systemic inflammatory response are major prognostic factors in patients with cirrhosis and acute functional renal failure. Hepatology 2007;46(6):1872-1882.
(63) Schmidt LE, Ring-Larsen H. Vasoconstrictor therapy for hepatorenal syndrome in liver cirrhosis. Curr Pharm Des 2006;12(35):4637-4647.
(64) Gluud LL, Christensen K, Christensen E, Krag A. Systematic review of randomized trials on vasoconstrictor drugs for hepatorenal syndrome. Hepatology 2010;51(2):576-584.
(65) Gines P, Schrier RW. Renal failure in cirrhosis. N Engl J Med 2009;361(13):1279-1290.
(66) Nazar A, Pereira GH, Guevara M, Martin-Llahi M, Pepin MN, Marinelli M et al. Predictors of response to therapy with terlipressin and albumin in patients with cirrhosis and type 1 hepatorenal syndrome. Hepatology 2010;51(1):219-226.
(67) Salerno F, Monti V. HRS type 1 and bacterial infection. A catastrophic association in patients with cirrhosis. Hepatology 2014;():1239-1241.
(68) Barreto R, Fagundes C, Guevara M, Sola E, Pereira G, Rodriguez E et al. Type-1 hepatorenal syndrome associated with infections in cirrhosis. Natural history, outcome of kidney function and survival. Hepatology 2013;59(4):1505-1513.
(69) Guevara M, Baccaro ME, Torre A, Gomez-Anson B, Rios J, Torres F et al. Hyponatremia is a risk factor of hepatic encephalopathy in patients with cirrhosis: A prospective study with time-dependent analysis. Am J Gastroenterol 2009;104:1382-1389.
(70) Londono MC, Guevara M, Rimola A, Navasa M, Taura P, Mas A et al. Hyponatremia impairs early posttransplantation outcome in patients with cirrhosis undergoing liver transplantation. Gastroenterology 2006 Apr 2006;1135-1143.
(71) Shchekochikhin D, Tkachenko O, Schrier RW. Hyponatremia: an update on current pharmacotherapy. Expert Opin Pharmacother 2013;14(6):747-755.
(72) Angeli P, Wong F, Watson H, Gines P. Hyponatremia in cirrhosis: Results of a patient population survey. Hepatology 2006;44(6):1535-1542.
