Guideline
| Download guideline |  |
 |
Anbefalinger
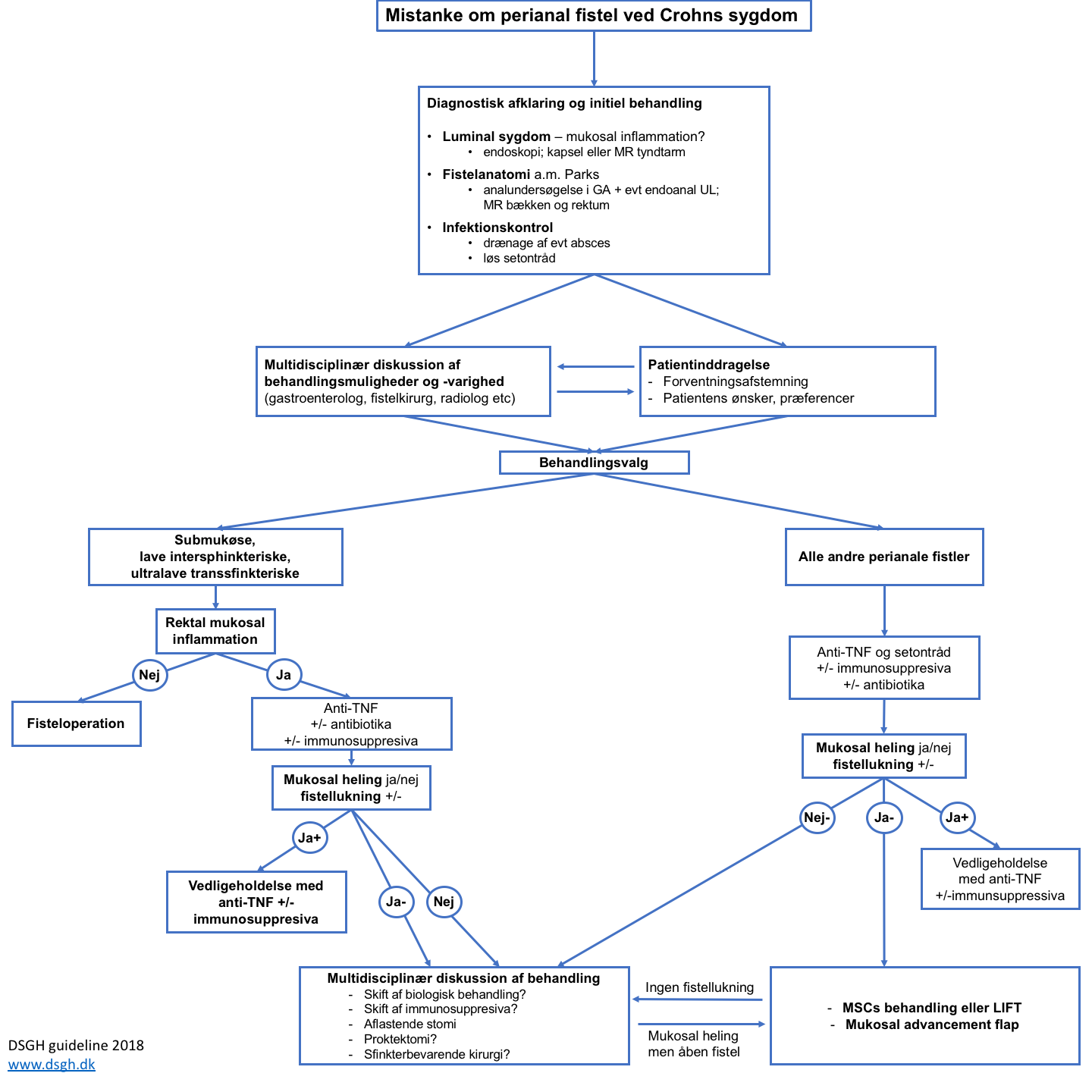
Diagnostik og behandling af fistler ved Crohns sygdom varetages i tæt samarbejde mellem gastroenterologisk, kirurgisk og radiologisk specialafdeling. Udredning og behandling følger omstående skema og flowchart. Behandling justeres efter generel kortlægning af gastrointestinal udbredning og sværhedsgrad af sygdom.
Børn født af mødre, som har modtaget anti-TNF behandling under graviditeten må ikke vaccineres med levende svækkede vacciner indenfor de første 12 måneder, med mindre der er påvist umålelige koncentrationer af lægemidlet i barnet. Den første levende svækkede vaccine (MFR) i det danske børnevaccinationsprogram gives, når barnet er 15 måneder gammel. Børnene kan således følge det danske børnevaccinationsprogram
Anbefalinger
Diagnostik og behandling af fistler ved Crohns sygdom varetages i tæt samarbejde mellem gastroenterologisk, kirurgisk og radiologisk specialafdeling. Udredning og behandling følger omstående skema og flowchart. Behandling justeres efter generel kortlægning af gastrointestinal udbredning og sværhedsgrad af sygdom.
|
Fisteltype |
Initial udredning |
Initial behandling |
Videre behandling |
|
Perianale (~55 % af alle) |
MR-skanning bækken og rektum EUA med rektoskopi, fistelsondering og anal ultralyd |
Simpel (submukøs, lav intersfinkterisk eller ultralav transsfinkterisk) fistel uden rektal inflammation: Abscesdrænage Fistulotomi kan overvejes. |
|
|
Simpel fistel med rektal inflammation; kompleks fistel: Absces drænage Seton-tråd Antibiotika (ciprofloxacin 1000 mg og/eller metronidazol 1500 mg dgl.) i 4-12 uger ved purulent sekretion. |
Infliximab/adalimumab behandling +/- immunsuppression. Overveje stamcellebehandling i protokolleret regi. Evt. definitiv kirurgisk fistellukning: Advancement flap. Ved utilfredsstillende effekt: Diversionsstomi eller proktektomi |
||
| Ano-vaginal fistel: Overveje stamcellebehandling (eksperimentel) | Advancement flap | ||
|
Interne (~30 % af alle) |
Kontrastundersøgelse MR/CT-skanning |
Entero-enterisk fistel: Hvis behandling nødvendig (symptomgivende fistler): Resektion af afficeret tarmafsnit |
|
|
Entero-vesikal fistel: Resektion af afficeret tarmafsnit |
|||
|
Eksterne (~15 % af alle) |
Evt. fistulografi |
Postoperativ enterokutan fistel: Stomipose og ernæringsterapi |
Ved manglende heling efter minimum 3-6 mdr.: Resektion af afficeret tarmafsnit |
|
Primær og anden enterokutan fistel: Stomipose; ernæringsterapi; infliximab/adalimumab |
Resektion af afficeret tarmsegment |
||
|
EUA inkl. GU/anal ultralyd |
Enterovaginal fistel: Fra tyndtarm/kolon fistel: Resektion af tarm |
||
|
Rekto-vaginal fistel: Evt. advancement flap og loop-ileostomi |
Proktektomi. Overveje stamcellebehandling i protokolleret regi. |
Indledning
Baggrund
Fistler forekommer hos 14-26 % af alle med Crohns sygdom1-3. Omtrent halvdelen af fistlerne er perianale, ca. 25 % er entero-enteriske, ca. 10 % er ano-vaginale og 10-15 % andre fistelforløb (entero-kutane, entero-vesikale)3. Hos 2/3 af alle patienter med fistler vil der være én fistelepisode, mens 1/3 vil have to eller flere fistelepisoder i løbet af 20 års erkendt sygdom3. Fisteltilstedeværelse markerer oftest et mere aggressivt forløb af Crohns sygdom (hyppigere indlæggelser, kirurgiske indgreb, steroidbehandling etc.)4.
Fistler opstår som en kommunikation fra et højtryksområde (tarmlumen) til et lavtryksområde (det perianale væv). Visse genetiske undertyper er koblet til fisteludvikling eksempelvis NOD2 variant rs727963535 og TNFSF15 rs4574921 CC genotype som hos koreanere var signifikant associeret med udviklingen af perianale fistler6. Tarmens mikrobiota medvirker til den lokale inflammation7. Fistelgange repræsenterer således en epithelialiseret kanal i et inflammationsområde med kommunikation mellem tarmen og en ydre overflade. Behandlingssuccessen er afhængig af, at der fokuseres på disse delelementer og sammensættes en medicinsk behandling (antibiotika og antiinflammatorisk behandling (TNF- antistof) samt kirurgi (lukning af indre munding og debridering af fistelgangen, eventuelt med samtidig stamcelletransplantation).
Diagnostik, vurdering og behandling af fistulerende Crohns sygdom er en kompleks opgave, der involverer gastroenterologisk, kirurgisk og billeddiagnostisk teamfunktion på højt specialiseret niveau8. Denne kliniske guideline er en opdatering af den initiale guideline fra 2010 og hviler på opdateret litteratursøgning og nye publicerede oversigtsarbejder, hvor enkelte centrale kan fremhæves9-12.
Definitioner
Fistel defineres som en patologisk forbindelse mellem to epitheliale overflader: tarmafsnit og ydre (hud/vagina) eller indre overflade (hulorganer/andet tarmafsnit)13.
Perianale fisteltyper bør, om muligt, anatomisk klassificeres efter Parks klassifikation:
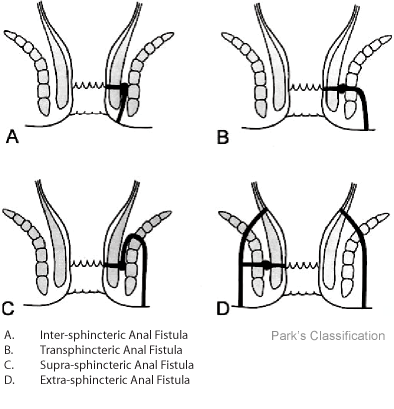
For praktiske behandlingsmæssige formål skelnes mellem simple og komplekse fistler:
- Simpel: superficiel/lav intersfinkterisk/lav transsfinkterisk, uden tegn til abscesdannelse eller anorektal striktur eller inflammation i rektum.
- Kompleks: høj intersfinkterisk/høj transsfinkterisk/ekstrasfinkterisk/suprasfinkterisk; kan have multiple åbninger eller ekstensioner, eventuelt abscedering, anovaginal fistulering, anorektal striktur samt rektal inflammation.
Fisteldrænage vurdering14:
- Lukning af individuel fistel: ophør af sekretion ved let bimanuel kompression.
- Forbedring: nedsættelse af åbne, secernerende fistler på 50 % i forhold til udgangsniveau ved mindst 2 konsekutive undersøgelser (efter mindst 3 uger).
- Remission: lukning af alle fistler i forhold til udgangsniveau ved mindst 2 konsekutive undersøgelser (efter mindst 3 uger).
- Definitiv fistellukning - defineret som lukning af fistel, hvor sondering ikke er muligt og fistegang/gangsystem ikke kan erkendes billeddiagnostisk.
Diagnostik og behandlingsmål ved perianale fistler
Diagnostik
Til kortlægning af fistlers anatomi er undersøgelse i generel anæstesi (EUA), MR-skanning af bækken og rektum samt endoanal ultralydsscanning nogenlunde ligeværdige15-18. Ved kombination af to af disse undersøgelser øges den diagnostiske sikkerhed17. For patienten er det umiddelbare mål, at fistelsekretion og abscesrisiko reduceres eller elimineres. Desuden vægtes det højt, at stomi og inkontinens undgås. Med medicinsk behandling kan man ofte opnå symptomfrihed eller betydelig bedring, men egentlig fistelheling efter medicinsk behandling er sjælden. Således vil en fistel oftest recidivere, når den medicinske behandling ophører.
Til vurdering af perianal sygdom foreslog Irvine et al. Perianal Disease Activity Index (PDAII)19, som er valideret og også anvendt som sekundært effektmål ved vurdering af perianale fistlers heling14. PDAI er således et anvendeligt og klinisk relevant system, som dog ikke specifikt er udviklet til vurdering af fistel-lukning. Reel fistellukning, defineret som at sondering ikke er mulig, og at en fistelgang ikke længere kan demonstreres billeddiagnostisk, anvendes kun i få studier. I stedet anvendes mere indirekte mål så som ophør eller nedsættelse af sekretion. Present et al. anvendte en Fistula Drainage Assessment til vurdering af fistelhelingen efter behandling med infliximab14, og dette system har opnået generel accept til klinisk vurdering20, 21.
Behandlingsmål
De forskellige definitioner gør det svært at vurdere og sammenligne behandlingseffekt. Væsentligt ved vurdering af effekt er opfølgningstid, og om fortsat fistelheling er afhængig af fortsat medicinering. I en international konsensusrapport anbefalede man, at kliniske studier over behandlingseffekt anvender MR-skanning samt klinisk undersøgelse for at vurdere fistelheling21. MR-scanning og klinisk fistellukning ved forsigtig kompression af ydre fistelmunding er også anvendt som behandlingsmål i de nyeste arbejder med stamcelletransplantation22-24.
Perianale fistler ved Crohns sygdom repræsenterer svær sygdom med betydelig negativ indflydelse på patienters livskvalitet. Den samlede vurdering af fistelbehandlinger bør endvidere omfatte patientcentrerede ønsker. Et nyt engelsk studie har igennem en Delphi konsensus med bidrag fra radiologer, kirurger, gastroenterologer og patienter udviklet et Core outcome set for fistulising perianal Crohn’s disease25. Patientrapporterede behandlingsmål er fokuseret på livskvalitet og de begrænsninger, der er forbundet med kontinensproblemer og restriktioner på baggrund af begrænset tilgang til ordnede toiletforhold26, 27.
Kliniske rekommandationer
- Primære behandlingsmål er infektionskontrol, ophør af fistelsekretion og optimeret livskvalitet
- Sekundære behandlingsmål er fistellukning
- Klinisk, paraklinisk, billeddiagnostisk samt patientrapporteret evaluering aftales individuelt
Medicinsk behandling af perianale fistler
Behandling med antibiotika
Ciprofloxacin og metronidazol er hyppigt anvendte lægemidler til perianale fistler, omend evidensen for deres effekt er sparsom. Der foreligger kun én randomiseret placebokontrolleret undersøgelse ved fistulerende Crohns sygdom, hvor man sammenlignede placebo (n=8), metronidazol 500 mg x 2 (n=7) og ciprofloxacin 500 mg x 2 (n=10) i 10 uger. Der var ikke statistik signifikant forskel mht. remission (Relativ risiko (RR): 1.68; 95% CI 0.34–8.22) eller respons/forbedring (RR:1.20; 95% CI 0.17–8.38)10, 28. Derudover findes der en række ukontrollerede studier, hvor antibiotika synes at kunne reducere symptomer, men sjældent giver komplet fistelheling og ofte recidiv ved seponering29-31. En meta-analyse, der inkluderede 1 kontrolleret og 2 ukontrollerede studier, fandt at antibiotika (Ciprofloxacin eller metronidazol) signifikant reducerede fistelsekretion (RR: 0.8; 95% CI 0.66–0.98)32.
Kliniske rekommandationer
- Ciprofloxacin eller metronidazol kan anvendes til symptomlindring, men medfører ikke fistellukning
- Antibiotika anvendes alene som supplement til anden medicinsk behandling
- For symptomgivende simple fistler kan antibiotika i kombination med anlagt setontråd anvendes
Behandling med azathioprin eller 6-mercaptopurin
Der foreligger ingen klinisk kontrollerede studier med azathioprin/6-mercaptopurin-behandling, hvor fistelheling var det primære endepunkt. En metaanalyse af fem randomiserede kliniske undersøgelser, hvor en undergruppe af de inkluderede patienterne havde perianal fistulerende sygdom ved indgang i studiet, viste gavnlig effekt af azathioprin og 6-mercaptopurin med fistelheling i 54 % af tilfældene, mens kun 21 % responderede ved placebo (odds ratio 4.4; 95% CI 1.5-13.2)33. Definitionerne af respons/forbedring varierer dog mellem undersøgelserne, og de egentlige helingsrater er usikre, hvorfor disse resultater skal tolkes med forsigtighed. En nyere meta-analyse, der kun inkluderede 4 af de ovenævnte 5 undersøgelser, kunne ikke demonstrere at azathioprin/6-mercaptopurin havde signifikant effekt mht. fistelheling (RR: 3.38; 95% CI 0.76–15.71) eller forbedring (RR 1.86; 95% CI 0.73–4.75)10.
Der findes ikke data vedrørende azathioprin/6-mercaptopurin-behandling til vedligeholdelsesbehandling ved perianale fistler.
I studier med luminal Crohns sygdom er supplerende thiopurinbehandling relateret til bedre effekt af anti-TNF34 og kan overvejes ved behov for at bedre eller forlænge effekten af anti-TNF behandling18.
Kliniske rekommandationer
- Monoterapi med azathioprin/6-mercaptopurin anbefales ikke til behandling af perianale fistler ved Crohns sygdom
- Tillæg af thiopuriner for at forstærke/forlænge effekt af anti-TNF kan overvejes
TNFα-antistoffer
Infliximab er den eneste TNFα–hæmmer, der er undersøgt specifikt til patienter med fistulerende Crohns sygdom. I en randomiseret, placebo-kontrolleret undersøgelse af infliximab (5 eller 10 mg/kg legemsvægt eller placebo), hvor 94 patienter havde mindst én secernerende fistel, havde 90 % perianale fistler og knap halvdelen alene én fistel14. Blandt de aktivt behandlede oplevede 68% bedring (svarende til 50 % reduktion i sekretion fra fistlen, studiets primære endepunkt) og 56 % fistellukning (sekundært endepunkt) inden for median få uger. Vedligeholdelsesbehandling i op til 12 måneder er dokumenteret bedre end placebo til at forebygge recidiv, men op til halvdelen af infliximab-behandlede patienter tabte respons inden for første års behandling35, 36. Der findes ingen data vedrørende infliximab ved simple perianale fistler.
Adalimumab er vurderet i et klinisk placebo-kontrolleret forsøg (160 mg, 80 mg og derefter 40 mg subkutant hver anden uge vs 40 mg ugentligt vs placebo) hos en subgruppe på 117 patienter med aktivt secernerende fistler (60 % perianale; 60 % kun en fistel). Der blev opnået fistelheling hos 36 % i adalimumab grupperne mod 16 % i placebogruppen efter 16 ugers behandling37. I open label extension fastholdtes respons op til 60 uger hos alle patienter, der havde primært respons efter 26 uger. Det er uafklaret, om langtidseffekten er præparatafhængig.
En meta-analyse af seks randomiserede, placebokontrollerede studier med TNFα–hæmmere kunne overordnet dokumentere signifikant effekt over for placebo med hensyn til forbedring (44 % vs 28 %; RR: 1.45; 95% CI 1.08-1.95), remission (35 % vs 16 %; RR: 2.01; 95% CI 1.36-2.97), vedligeholdelse af forbedring (43 % vs 22 %; RR: 1.97; 95% CI 1.34-2.89) samt vedligeholdelse af remission (35 % vs 18 %; RR: 1.97; 95% CI 1.25-3.02)10.
To randomiserede placebokontrollerede undersøgelser har undersøgt effekten af ciprofloxacin i kombination med TNFα-inhibitorer (hhv. infliximab38 og adalimumab39) over for monoterapi med TNFα-inhibitorer. Resultaterne er samlet i en meta-analyse, der fandt at kombinationen af antibiotika og TNFα-inhibitor var mere effektiv mht. at opnå forbedring (RR: 1.58; 95% CI 1.09–2.28) samt til at inducere remission (RR: 1.94; 95% CI 1.14–3.29)10 ved perianale fistler. Effekten kunne dog ikke fastholdes gennem hele studieperioden, hvilket tyder på at antibiotika kun har en rolle ift. at inducere forbedring/remission39.
Kliniske rekommandationer
- Biologisk behandling med infliximab eller adalimumab kan anvendes som primær behandling og vedligeholdelsesbehandling af perianale fistler ved Crohns sygdom
- Tillæg af antibiotika øger effekten på kort sigt og kan overvejes
Anti-α4β7 integrin antistof
Integrinhæmmeren vedolizumab er ikke undersøgt i randomiserede studier med fistelheling som primært effektmål, og studierne begrænses ved hovedsagelig at inkludere patienter med svigt af TNF-hæmmerbehandling9. I GEMINI 2 studiet blev 368 patienter randomiseret til vedolizumab eller placebo, og 747 fik open label behandling. 461 patienter responderede på 16 ugers behandling og disse blev derefter randomiseret til enten vedolizumab hver 4. eller 8. uge eller placebo i 46 uger40. I en eksplorativ analyse fra GEMINI 2-studiet af disse 461 patienter havde 57 patienter (12 % af den samlede studiepopulation) aktiv perianal fistelsygdom ved inklusion i remissionsstudiet41. Man så fistellukning uge 52 hos 31 % af de vedolizumab-behandlede mod 11 % i placebogruppen (absolut risikoreduktion 20%; 95% CI -9 – 46%).
Klinisk rekommandation
- Vedolizumab kan have gavnlig effekt ved perianal fistelsygdom, men der er utilstrækkelige data til at give klinisk rekommandation
Anti-IL12p40/IL-23 antistof
Det monoklonale antistof ustekinumab er registreret til brug ved moderat til svær Crohns sygdom, hvor der er svigt eller ingen effekt af TNF-hæmmer. Det er ikke undersøgt med fistelsygdom som primært effektmål, og studierne begrænses ved alene at inkludere patienter med svigt af TNF-hæmmer9. En posthoc analyse, som alene er præsenteret i abstractform, baseres på fem kliniske studier og er refereret i et nyligt review10. Man fandt en mulig og ikke statistisk signifikant bedre effekt på fistellukning af ustekinumab i forhold til placebo.
Klinisk rekommandation
- Der er utilstrækkelige data til at give anbefaling om behandling med ustekinumab ved fistelsygdom
Andre lægemidler
Der foreligger ingen evidens for brugen af 5-aminosalicylat eller kortikosteroid ved perianal fistulerende Crohns sygdom, og disse lægemidler bør derfor ikke bruges til denne indikation.
For ciclosporin, parenteral ernæring, mycofenolat mofetil, methotrexat, thalidomid, granolocyte-macrophage-colony stimulerende faktor, aktivt kul, hyperbar oxygenering, sargramostim og natalizumab (Tysabri®) foreligger der kun få og mindre ukontrollerede studier eller case-serier, og de kan derfor ikke anbefales. Tacrolimus 0.2 mg/kg/dag er i et lille randomiseret placebo-kontrolleret studie vist at kunne inducere bedring (lukning af ≥50 % af fistler), men ikke opheling (lukning af 100 % af fistler) efter 4 ugers behandling42.
Kirurgi for perianale fistler ved Crohns sygdom
Den kirurgiske behandling af perianale Crohn-fistler er kompleks. Præsentationen, sygdomsforløbet og udbredelsen af fistelsygdommen er forskelligartet og behandlingen forudsætter ofte langvarig medicinsk behandling og multiple kirurgiske indgreb23, 43. Behandlingen vanskeliggøres af nedsat sårheling hos disse patienter, i særdeleshed ved samtidig perianal sepsis44 og løse afføringer.
Introduktionen af biologisk behandling og udviklingen af nye sfinkterbevarende kirurgiske teknikker har øget fokus på den kirurgiske fistelbehandling. Definitiv kirurgi for perianal Crohns sygdom forudsætter oftest supplerende præ- og postoperativ biologisk terapi45. Forekomsten af granulomer ved biopsi perianalt og inflammation i rektum med stenose er associeret med en dårlig prognose4, 46-49. Det er generelt accepteret, at kombinationen af biologisk behandling og kirurgi er bedre end biologisk behandling alene, i særdeleshed ved samtidig perineal involvering45, 50-52. Behandlingen af perianale Crohn fistler er derfor multimodal, men generelt er der mangel på level 1 evidens vedr. selve den kirurgiske behandling, og der må ofte forventes multiple kirurgiske indgreb. For de kliniske studier gælder, at patienterne typisk er inkluderet efter optimeret medicinsk behandling af luminal sygdom og samtidigt svigt eller relaps efter en eller to kirurgiske behandlinger.
Den kirurgiske tilgang og valg af metode bør tage udgangspunkt i patientens symptomer, patoanatomi, præferencer og livskvalitet. Den kan med fordel anskues i tre trin:
- Infektionskontrol: Incision af absces
- Inflammationskontrol: Setontråd i fistlen og evt. gentagne oprensninger af fistel systemet
- Definitiv fistelkirurgi: Lay-open, sfinkterbevarende procedure eller fistulektomi og rekonstruktion.
1) Infektionskontrol – abscesdrænage
Den hyppigste kirurgiske procedure for perianal Crohn’s sygdom er abscesdrænage, og principperne herfor adskiller sig ikke fra behandling af almindelig perianal absces21. Incisionen bør anlægges, således at skaden på sfinkterapparatet bliver så minimal som muligt. Høje intersfinkteriske og supralevatoriske abscesser skal dræneres endoluminalt. Man bør ikke sondere efter fistel i det akutte forløb grundet risikoen for via falsa dannelse. Identificeres fistlen nemt i det akutte forløb, f.eks. vha. endoanal ultralyd, kan der anlægges løs setontråd53.
Perianale fistler kan være primære eller sekundære til tidligere inflammation. Den hyppigste kliniske situation er fund af en eller flere fistler efter behandling af perianal absces. Fistlerne er oftest komplekse, hvorfor behandlingsresultatet er afhængig af en nøje kortlægning af fistelkomplekset54, 55.
Undersøgelse i generel anæstesi (EUA) er generelt antaget at være guldstandard for kortlægningen af fistelforløbet. Desværre tillader EUA ikke endegyldig afklaring af andelen af sfinkterinvolvering og af eventuelle blinde udløbere. EUA bør således suppleres med MR og/eller endoanal UL; sidstnævnte har den fordel, at den kan gentages peroperativt og hjælpe ved fistelsondering og abscesdrænage, samtidig med at teknikken har samme sensitivitet som MR56.
2) Inflammationskontrol – setontråd
Ved perianale Crohn fistler vil 29-47 % af tilfældene være transsfinkteriske eller komplekse.57 Her anbefales primær anlæggelse af en løs Setontråd i fistlen for at hindre abscesdannelse og for at undgå læsion på analsfinkter58-60. Setontråden er ikke kurativ; således var der i en undersøgelse af 23 patienter kun 3 patienter, hvor fistlen var lukket 3 år efter seponering af suturen.61 Med den løse setontråd har man opnået symptomfrihed hos 75 % med en follow-up periode på 35-101 uger.62 I nogle tilfælde er det at foretrække at lade setontråden ligge, da den sjældent giver væsentlige gener, og da den definitive kirurgiske behandling af de transsfinkteriske og komplekse fistler er vanskelig med risiko for kontinensproblemer. Den palliative setontråd kan således anvendes, hvis det er patientens præference, hvis sfinkterbevarende teknikker er fejlet eller ikke mulige, og hvis lay-open indebærer betydelig risiko for afføringsinkontinens.
3) Definitiv fistelkirurgi
Den lave submukøse fistel kan primært behandles med fistulotomi eller ”lay-open” med en helingsfrekvens på 75-85 %63, 64. Oftest er de sfinkterbevarende teknikker (som anført nedenfor) at foretrække af hensyn til patientens kontinens. Definitiv kirurgisk behandling af komplekse fistler bør primært varetages med anvendelsen af sfinkterbevarende teknikker, men hos patienter med fækal inkontinens og sfinkterdefekt kan fistulektomi og sfinkterrekonstruktion være nødvendig. Det er essentielt, at sekundære tracks (udløbere fra den primære fistelgang) adresseres inden lukningsforsøg af den primære fistelgang.65 Generelt er disse teknikker associerede med få bivirkninger og kan gentages eller erstattes af en af de andre teknikker ved manglende heling.
Advancement flap
Behandlingsprincippet er en advancement flap af mucosa, submucosa og evt. en del af interne sfinkter. I et review af Soltani et al.66 fra 2010 af 35 publicerede studier (primært små case series, <10 patienter) var helingsraten hos Crohn patienter 64 %, men inkontinensraten var 9,4 %. I de største af de inkluderede studier steg recidivforekomsten betydeligt med længere follow-up. Dette sammenholdt med en inkontinensrate på næsten 10 % gør, at man bør være varsom med anvendelse af teknikken. Recidivfrekvensen ved advancement flap stiger tillige med antallet af forsøg. Aflastende stomi bør derfor overvejes ved reoperation.67
Fibrinklæber og plug
Der foreligger to randomiserede studier vedr. brug af fibrinklæber. I studiet af Lindsey et al.68 udgjorde Crohn patienter kun en subpopulation. Ved simple fistler blev der opnået heling hos alle ved fistulotomi og kun 50 % ved fibrinklæber. Ved de komplekse fistler blev der opnået heling hos 69 % i fibrinklæbergruppen sammenlignet med 13 % ved konventionel (i.e. løs seton +/- efterfølgende advancement flap) kirurgi. I et nyere studie blev 36 Crohn patienter randomiseret til fibrinklæberbehandling mod 41 patienter i kontrolgruppen, der blot blev observeret efter setonseponering.69 Succesraten ved fibrinklæber var 38 %, hvilket var signifikant bedre (p = 0.04) end i kontrolgruppen. Effekten var mest udtalt for simple fistler.
Fistel plugs (biologisk materiale fremstillet fra tarmmucosa fra svin): Den bedste evidens haves fra et randomiseret, klinisk studie, hvor 54 patienter med perianale Crohn fistler blev randomiseret til behandling med plug.70 Kontrolgruppen blev behandlet med seponering af seton. Overall healing var 31,5 %, hvilket ikke var signifikant bedre end for kontrolgruppen.
Ovesco clips
Ovesco clipsen er en elastisk nitinol clips, der monteres over den indre fistelåbning med intentionen at fistelforløbet perifert herefter lukker. Der er publiceret i alt 4 kohortestudier med teknikken, hvor Crohn patienter desværre kun udgør en lille subpopulation med hhv. 8, 3, 6 og 6 patienter.71-74 Helingsraterne varierede mellem 33 % (1 af 3 patienter) – 83 % (5 af 6 patienter), men der var ingen kontrolgrupper.
LIFT
Som for de øvrige teknikker er evidensen for LIFT (Ligation of the Intersphincteric Fistula Tract) hos Crohn patienter sparsom. Kaminski et al.75 publicerede i 2017 en retrospektiv serie på 23 patienter med Crohnbetingede transsfinkteriske fistler behandlet med LIFT. 48 % af patienterne var helede ved en median follow-up på 23 måneder.
FiLaC
Fistula Laser Closure (FiLaC) er en relativ ny, sfinkterbevarende teknik, hvor en radiært emitterende laserprobe føres gennem fistelgangen, som herefter laserablateres med eller uden lukning af den indre åbning med sutur, advancement flap el. anden teknik. Igen er evidensgrundlaget hos Crohnpatienter sparsomt. Den største serie findes i et prospektivt kohortestudie af Wilhelm et al.76 på 117 patienter, hvoraf 13 havde Crohn af forskellig anatomisk kompleksitet. Primær helingsrate var hos Crohnpatienterne 69,2 %. FiLaC blev gentaget hos de patienter, der ikke havde succes i første ombæring, hvorved en sekundær helingsrate på 92,3 % blev opnået. Helingsraten var ikke signifikant forskellig fra patienter med kryptoglandulære non-Crohn fistler.
Aflastende stomi bør overvejes ved ukontrollabel eller svær recidiverende perianal sepsis, inkontinens og udtalt sekretion fra fistlerne, men det skal haves in mente at op til 2/3 af disse patienter har behov for yderligere kirurgi, herunder proktektomi77, 78. Det er endvidere beskrevet, at Crohn patienter med perianal sygdom kan få en øget livskvalitet ved behandling med stomi.79 En aflastende stomi kan resultere i remission hos 83% af patienterne med svær perianal Crohn.80 Udsigten til at få lukket en midlertidig stomi på langt sigt afhænger af en række kliniske variable. Er indikationen perianal fistel, rektovaginal fistel og kompliceret rektal inflammation, er chancen kun 40 %81. Ved svær perianal Crohn er risikoen for permanent stomi 49 % syv år efter sygdomsdebut. Multivariabel analyse har vist, at samtidig colon-Crohn og analstenose er prædiktorer for permanent stomi82.
Proktokolektomi er en definitiv behandlingsmulighed, men er forbundet med høj komplikationsrate78. Perineale sårproblemer forekommer hos 35 %, intraabdominal sepsis hos 17 % og stomikomplikationer hos 15 %. Anvendelsen af myokutane flaps kan reducere frekvensen af perineale sårkomplikationer83.
Kliniske rekommandationer
- Abscesser skal dræneres
- Kirurgisk behandling forudsætter oftest præ- og postoperativ medicinsk behandling
- Biologisk terapi fortsættes som hovedregel mindst et år efter kirurgisk intervention.
- Luminalt respons bør optimeres inden kirurgisk intervention
- Simple lave symptomgivende fistler kan behandles med fistulotomi
- Primær behandling af komplekse fistler er anlæggelse af løs setontråd for at opnå inflammationskontrol
- Definitiv kirurgisk behandling af komplekse fistler bør primært varetages med anvendelsen af sfinkterbevarende teknikker, men hos patienter med fækal inkontinens og sfinkterdefekt kan fistulektomi og sfinkterrekonstruktion være nødvendig
- Aflastende stomi kan i sig selv medføre remission af perianal Crohns sygdom
Stamcellebehandling
Adipocytderivede, mesenchymale stamceller (ASC) er multipotente celler, som har immunsupprimerende egenskaber og kan dæmpe uhensigtsmæssige immunreaktioner9, 11, 12. Når ASC injiceres i et væv, dannes antiinflammatoriske cytokiner, som hæmmer overproduktionen af inflammatoriske immunceller (T- og B-lymfocytter og monocytter) og bevirker en nedsat inflammation. ASC fremskaffes fra fedtvæv ved fedtsugning enten fra patienten selv (autolog) eller fra en donor (allogen). Proceduren består af en lukning af fistelgangens indre munding, hvorefter fedtvæv eller opdyrkede stamceller injiceres i og omkring fistelgangen84, 85.
Det første kliniske studie til lukning af anale fistler med autolog fedtvæv blev publiceret i 200586, og siden er der publiceret et stigende antal studier med anvendelsen af både autologe87-89 og allogene90, 91 ASC. Helingsraten varierer mellem 30 % og 88 %, hvoraf de fleste studier rapporterer en helingsrate på omkring 70 %.
I et større placebokontrolleret randomiseret studie fandt man, at 50 % af de patienter, der var behandlet med opdyrkede allogene stamceller (Cx601), helede både ved klinisk undersøgelse og vurderet ved en MR-scanning sammenholdt med 34 % i placebogruppen. Opfølgningen var 24 uger. Der var ingen forskel på bivirkninger i de to grupper, og der blev ikke rapporteret om alvorlige komplikationer92. Ved et års follow-up var helingsraten steget til 56 % i Cx601 gruppen og til 39 % i placebogruppen24. Cx601 (darvadstrocel, Aloficel®) er godkendt af EMA og Lægemiddelstyrelsen og afventer ved afslutning af denne revision 13.6.2018 vurdering i Medicinrådet.
Et fase I studie blev publiceret i 2017, hvor autologe stamceller blev appliceret på en plug, som blev fastgjort i fistelgangen. Helingsraten var 83 % efter 6 måneder22. Endelig viste et pilotstudie fra 2018 med to grupper af patienter, at 83 % af patienterne, der ikke tidligere havde fået et forsøg på lukning af fistlen helede efter 6 måneder, hvorimod patienter der tidligere var behandlet med sphincterbevarende metoder kun havde en succesrate på 57 %93.
Hos patienter med anovaginale fistler viser præliminære resultater en helingsrate på 77 %. I materialet indgik patienter med Crohns sygdom og patienter med fistler, opstået efter strålebehandling94.
Medicinsk forbehandling: Der foreligger ikke egentlige anbefalinger til medicinsk forbehanding inden stamcelletransplantation. I det første open label fase I studie med ekspanderede allogene fedtcelle deriverede mesenchymale stamceller måtte der ikke gives TNF- antistof eller tacrolimus behandling 8 uger forud for stamcellebehandlingen. Der måtte ikke være sygdomsaktivitet (CDAI score < 200)90. I det første større kontrollerede studie af Panes et al. med Cx60192, som har opnået EMA godkendelse til behandling af fistulerende Crohns sygdom, måtte der kun være mild luminal sygdomsaktivitet (CDAI < 220). Biologisk terapi fortsatte i uændret dosis igennem hele observationsperioden. Samme forhold er anvendt i andre mindre studier af stamcelletransplantation22, 23, 95.
Kliniske rekommandationer
- Behandling med fedtderiverede stamceller bør foregå i protokolleret regi med henblik på at fastlægge indikation, behandlingsmodalitet, klinisk effekt, behandlingsalgoritmer, ledsagende medicinsk behandling etc.
- Behandling af luminal inflammation bør være optimeret inden stamcellebehandling indledes.
- Der kan ikke gives kliniske anbefalinger for medicinsk forbehandling i forbindelse med stamcellebehandling.
Kombineret medicinsk-kirurgisk behandling af perianale fistler ved Crohn sygdom
Isoleret medicinsk eller kirurgisk behandling har i bedste fald en responsrate på 40-75 % med betydelig variation afhængig af definition på respons/forbedring, type af fistel samt valgte behandling. Når disse behandlinger hver for sig ikke giver det ønskede resultat, synes en kombination af medicinsk og kirurgisk behandling attraktiv, i betragtning af patientens underliggende Crohns sygdom. To publicerede reviews fra henholdsvis 2014 og 201712, 51 har gennemgået litteraturen over eksisterende viden om kombinationsbehandling ved perianal fistulerende Crohns sygdom. Supplerende har ECCO i 2017 publiceret en guideline21 foruden et flowdiagram over behandlingsstrategi (ECCO e-Guide). Sammenlignende enkelt (medicinsk/kirurgisk) med kombineret behandling har vist remissionsrater på henholdsvis 43 % og 52 %. Imidlertid var de inkluderede studier heterogene og med inkomplette data for fistelheling12, 51.
Prognostiske faktorer for fistelheling er ileo-kolisk Crohn, samtidig immunssupprimerende behandling, varighed af behandling med setontråd samt varighed af anti-TNF behandling96, 97. Uanset valg af behandling skal drænage af ansamling/abces sikres, og speciel opmærksomhed henledes på samtidig aktiv Crohn-inflammation i rektum og rektosigmoideum.25, 26.
Anti-TNF behandling, efter sikret drænage af evt. ansamlinger, har i kombination med kirurgisk behandling vist øget effekt sammenlignet med hver behandling for sig21, 98, samt længerevarende repons og dermed lavere recidivrate45, 51, 55, 99, 100. Fistelheling eller symptombedring kunne opnås hos 45-80 % ved kombineret behandling mod 20-85 % ved alene kirurgisk behandling. Den betydelige variation i effekt fandtes afhængig af type kirurgi, fistel type samt patientpopulation15, 20.
Flowchart med skematisk præsentation af kombineret medicinsk-kirurgisk behandling:

Non-perianale fistler
Behandling af non-perianale fistler
Entero-kutane fistler: Der skelnes mellem postoperative og primære entero-kutane fistler. De postoperative fistler udgør langt størstedelen101, 102. Fistler, som er opstået inden for de første postoperative uger, kan skyldes anastomoselækage eller ikke-erkendt accidentiel tarmlæsion. Størstedelen (60-75 %) af disse fistler vil lukke efter konservativ behandling med stomipose og ernæringsterapi101-103. Hvis fistlen ikke lukker under konservative behandling, må den involverede tarm og fistel reseceres. Timing af operationen er afgørende og bør tidligst foretages efter ca. tre måneder101, 104. Fistler, der opstår senere i det postoperative forløb, udgår typisk fra et anastomoseområde105, 106. Resektion af fistel og det afficerede tarmsegment er da som regel indiceret. Primære entero-kutane fistler udgår fra tarm med aktiv Crohns sygdom. Ved væsentlig comorbiditet eller risiko for korttarmssyndrom efter kirurgi kan medicinsk behandling forsøges. Permanent lukning opnås dog sjældent uden kirurgisk intervention107. Stominære entero-kutane fistler kan, hvis de sidder tæt på stomien, ofte behandles konservativt med passende bandagering. Ellers vil behandlingen være kirurgisk med revision eller flytning af stomi.
Entero-vaginale fistler: Rekto- og anovaginale fistler er de hyppigste108 og findes hos 5-10 % af kvindelige Crohn-patienter109. Jo mere analt fistlen ligger, desto bedre synes helingsprognosen at være. Omvendt mindsker aktiv tyndtarms-Crohn og proktitis sandsynligheden for succesfuld kirurgisk behandling110-112. Transrektal eller transvaginal advancement flap er de hyppigst anvendte operationer uden signifikante forskelle i outcome med primære fistellukningsrater på hhv. 54 % og 69 %113. Kombineret kirurgisk og medicinsk behandling med infliximab synes ikke at øge helingsraten98. Tyndtarms-, kolo–vaginale og andre enterogynækologiske fistler kan som regel behandles med resektion af sygdomsbærende tarm og lukning af fistel21.
Entero-enteriske fistler. Hos ca. en tredjedel af patienter opereret for Crohns sygdom fandtes interne fistler; heraf havde kun 54% fået stillet en præcis præoperativ diagnose114. Fistlerne er ofte asymptomatiske105, og tilstedeværelse af fistel alene giver sjældent operationsindikation (6 %)105, 114. Ved symptomatiske fistler er behandlingen resektion af det sygdomsbærende tarmsegment.
Entero-vesikale fistler. Fistler til blæren er relativt sjældne (2 %)115 og manifesterer sig typisk ved recidiverende urinvejsinfektioner og pneumaturi115, 116. Diagnosen kan være vanskelig at underbygge med billeddiagnostik114, 117, men CT-skanning og fistulografi synes mest anvendelige. Behandlingen er i de fleste tilfælde resektion af det sygdomsbærende tarmsegment og lukning af blæredefekten115, 116.
Kliniske rekommandationer
- Tidlige postoperative enterocutane fistler: konservativ behandling (væske-elektrolyt behandling, evt. abscesdrænage, sårkontrol med hudbeskyttelse, parenteral ernæring). Ved manglende effekt heraf gøres resektion af den involverede tarm og fistel (tidligst 3-6 mdr. postoperativt).
- Sene postoperative enterocutane fistler: Resektion af fistlen og det afficerede tarmsegment.
- Rekto- og anovaginale fistler: Transrektal eller transvaginal advancement flap operation.
- Tyndtarms eller kolo–vaginale fistler: Resektion af sygdomsbærende tarm og lukning af fistel.
- Entero-enteriske fistler: Kun behandling ved symptomer og da resektion af det sygdomsbærende tarmsegment og simpel lukning af fistelmundingen.
- Entero-vesikale fistler: Resektion af det sygdomsbærende tarmsegment
Forfattere og korrespondance
Jørgen Steen Agnholt, Johan Burisch, Jens Frederik Dahlerup, Christian Lodberg Hvas (tovholder), Bent Ascanius Jacobsen, Lilli Lundby, Inge Nordgaard-Lassen, Andreas Nordholm-Carstensen, Niels Qvist.
Korrespondance:
Overlæge Christian Lodberg Hvas, Lever-, Mave- og Tarmsygdomme (Medicinsk Afdeling V), Aarhus Universitetshospital, Palle Juul-Jensens Boulevard 99, 8200 Aarhus N, e-mail This email address is being protected from spambots. You need JavaScript enabled to view it.
Status
| Første udkast | |
| Diskuteret til Aarsmødet | |
| Korrigeret udkast | |
| Endelig guideline | dec 2010 |
| Revideret guideline | aug 2018 |
| Guideline skal revideres senest | sep 2024 |
Afgrænsning af emnet
Denne vejledning omfatter diagnostik og behandling af fistler hos voksne patienter med Crohns sygdom.
Definitioner
Ej udfyldt
Litteratur søgning
Litteratursøgning er afsluttet 13.06.2018.
Søgeord: Der er søgt via Pubmed (http://www.ncbi.nlm.nih.gov/pubmed) med brug af Medical Subject Headings (MeSH) ordene intestinal fistula og Crohn disease og ved angivelse af begrænsninger (limits) species (human), languages (English) samt ved søgning efter randomiserede kliniske undersøgelser type of article (clinical trials). Identificerede oversigtsarbejder er gennemgået for originalartikler med relevans for emnet.
Interessekonflikter
Ikke angivet
Referencer
1. Schwartz DA, Loftus EV, Jr., Tremaine WJ, et al. The natural history of fistulizing Crohn's disease in Olmsted County, Minnesota. Gastroenterology 2002;122:875-80.
2. Lapidus A. Crohn's disease in Stockholm County during 1990-2001: an epidemiological update. World J Gastroenterol 2006;12:75-81.
3. Tang LY, Rawsthorne P, Bernstein CN. Are perineal and luminal fistulas associated in Crohn's disease? A population-based study. Clin Gastroenterol Hepatol 2006;4:1130-4.
4. Ingle SB, Loftus EV, Jr. The natural history of perianal Crohn's disease. Dig Liver Dis 2007;39:963-9.
5. Schnitzler F, Friedrich M, Wolf C, et al. The NOD2 Single Nucleotide Polymorphism rs72796353 (IVS4+10 A>C) Is a Predictor for Perianal Fistulas in Patients with Crohn's Disease in the Absence of Other NOD2 Mutations. PLoS One 2015;10:e0116044.
6. Yang DH, Yang SK, Song K, et al. TNFSF15 is an independent predictor for the development of Crohn's disease-related complications in Koreans. J Crohns Colitis 2014;8:1315-26.
7. Tozer PJ, Rayment N, Hart AL, et al. What role do bacteria play in persisting fistula formation in idiopathic and Crohn's anal fistula? Colorectal Dis 2015;17:235-41.
8. Nielsen OH, Rogler G, Hahnloser D, et al. Diagnosis and management of fistulizing Crohn's disease. Nat Clin Pract Gastroenterol Hepatol 2009;6:92-106.
9. Kotze PG, Shen B, Lightner A, et al. Modern management of perianal fistulas in Crohn's disease: future directions. Gut 2018;67:1181-1194.
10. Lee MJ, Parker CE, Taylor SR, et al. Efficacy of Medical Therapies for Fistulizing Crohn's Disease: Systematic Review and Meta-Analysis. Clin Gastroenterol Hepatol 2018.
11. Lightner AL, Wang Z, Zubair AC, et al. A Systematic Review and Meta-analysis of Mesenchymal Stem Cell Injections for the Treatment of Perianal Crohn's Disease: Progress Made and Future Directions. Dis Colon Rectum 2018;61:629-640.
12. Panes J, Rimola J. Perianal fistulizing Crohn's disease: pathogenesis, diagnosis and therapy. Nat Rev Gastroenterol Hepatol 2017;14:652-664.
13. Tottrup A, Basu D. [Surgical treatment of Crohn disease]. Ugeskr Laeger 2004;166:571-4.
14. Present DH, Rutgeerts P, Targan S, et al. Infliximab for the treatment of fistulas in patients with Crohn's disease. N Engl J Med 1999;340:1398-405.
15. Beckingham IJ, Spencer JA, Ward J, et al. Prospective evaluation of dynamic contrast enhanced magnetic resonance imaging in the evaluation of fistula in ano. Br J Surg 1996;83:1396-8.
16. Beets-Tan RG, Beets GL, van der Hoop AG, et al. Preoperative MR imaging of anal fistulas: Does it really help the surgeon? Radiology 2001;218:75-84.
17. Schwartz DA, Wiersema MJ, Dudiak KM, et al. A comparison of endoscopic ultrasound, magnetic resonance imaging, and exam under anesthesia for evaluation of Crohn's perianal fistulas. Gastroenterology 2001;121:1064-72.
18. Buchanan GN, Halligan S, Bartram CI, et al. Clinical examination, endosonography, and MR imaging in preoperative assessment of fistula in ano: comparison with outcome-based reference standard. Radiology 2004;233:674-81.
19. Irvine EJ. Usual therapy improves perianal Crohn's disease as measured by a new disease activity index. McMaster IBD Study Group. J Clin Gastroenterol 1995;20:27-32.
20. Sandborn WJ, Feagan BG, Hanauer SB, et al. A review of activity indices and efficacy endpoints for clinical trials of medical therapy in adults with Crohn's disease. Gastroenterology 2002;122:512-30.
21. Gionchetti P, Dignass A, Danese S, et al. 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn's Disease 2016: Part 2: Surgical Management and Special Situations. J Crohns Colitis 2017;11:135-149.
22. Dietz AB, Dozois EJ, Fletcher JG, et al. Autologous Mesenchymal Stem Cells, Applied in a Bioabsorbable Matrix, for Treatment of Perianal Fistulas in Patients With Crohn's Disease. Gastroenterology 2017;153:59-62.e2.
23. Molendijk I, Bonsing BA, Roelofs H, et al. Allogeneic Bone Marrow-Derived Mesenchymal Stromal Cells Promote Healing of Refractory Perianal Fistulas in Patients With Crohn's Disease. Gastroenterology 2015;149:918-27.e6.
24. Panes J, Garcia-Olmo D, Van Assche G, et al. Long-term Efficacy and Safety of Stem Cell Therapy (Cx601) for Complex Perianal Fistulas in Patients With Crohn's Disease. Gastroenterology 2018;154:1334-1342.e4.
25. Sahnan K, Tozer PJ, Adegbola SO, et al. Developing a core outcome set for fistulising perianal Crohn's disease. Gut 2018.
26. Canete F, Domenech E. Editorial: faecal incontinence-the hidden burden of inflammatory bowel diseases. Aliment Pharmacol Ther 2018;47:1715-1716.
27. Vollebregt PF, van Bodegraven AA, Markus-de Kwaadsteniet TML, et al. Impacts of perianal disease and faecal incontinence on quality of life and employment in 1092 patients with inflammatory bowel disease. Aliment Pharmacol Ther 2018;47:1253-1260.
28. Thia KT, Mahadevan U, Feagan BG, et al. Ciprofloxacin or metronidazole for the treatment of perianal fistulas in patients with Crohn's disease: a randomized, double-blind, placebo-controlled pilot study. Inflamm Bowel Dis 2009;15:17-24.
29. Bernstein LH, Frank MS, Brandt LJ, et al. Healing of perineal Crohn's disease with metronidazole. Gastroenterology 1980;79:599.
30. Brandt LJ, Bernstein LH, Boley SJ, et al. Metronidazole therapy for perineal Crohn's disease: a follow-up study. Gastroenterology 1982;83:383-7.
31. Jakobovits J, Schuster MM. Metronidazole therapy for Crohn's disease and associated fistulae. Am J Gastroenterol 1984;79:533-40.
32. Khan KJ, Ullman TA, Ford AC, et al. Antibiotic therapy in inflammatory bowel disease: a systematic review and meta-analysis. Am J Gastroenterol 2011;106:661-73.
33. Pearson DC, May GR, Fick GH, et al. Azathioprine and 6-mercaptopurine in Crohn disease. A meta-analysis. Ann Intern Med 1995;123:132-42.
34. Colombel JF, Sandborn WJ, Reinisch W, et al. Infliximab, azathioprine, or combination therapy for Crohn's disease. N Engl J Med 2010;362:1383-95.
35. Behm BW, Bickston SJ. Tumor necrosis factor-alpha antibody for maintenance of remission in Crohn's disease. Cochrane Database Syst Rev 2008:Cd006893.
36. Sands BE, Anderson FH, Bernstein CN, et al. Infliximab maintenance therapy for fistulizing Crohn's disease. N Engl J Med 2004;350:876-85.
37. Colombel JF, Schwartz DA, Sandborn WJ, et al. Adalimumab for the treatment of fistulas in patients with Crohn's disease. Gut 2009;58:940-8.
38. West RL, van der Woude CJ, Hansen BE, et al. Clinical and endosonographic effect of ciprofloxacin on the treatment of perianal fistulae in Crohn's disease with infliximab: a double-blind placebo-controlled study. Aliment Pharmacol Ther 2004;20:1329-36.
39. Dewint P, Hansen BE, Verhey E, et al. Adalimumab combined with ciprofloxacin is superior to adalimumab monotherapy in perianal fistula closure in Crohn's disease: a randomised, double-blind, placebo controlled trial (ADAFI). Gut 2014;63:292-9.
40. Sandborn WJ, Feagan BG, Rutgeerts P, et al. Vedolizumab as induction and maintenance therapy for Crohn's disease. N Engl J Med 2013;369:711-21.
41. Feagan BG, Schwartz D, Danese S, et al. Efficacy of Vedolizumab in Fistulising Crohn's Disease: Exploratory Analyses of Data from GEMINI 2. J Crohns Colitis 2018;12:621-626.
42. Sandborn WJ, Present DH, Isaacs KL, et al. Tacrolimus for the treatment of fistulas in patients with Crohn's disease: a randomized, placebo-controlled trial. Gastroenterology 2003;125:380-8.
43. Chaparro M, Zanotti C, Burgueno P, et al. Health care costs of complex perianal fistula in Crohn's disease. Dig Dis Sci 2013;58:3400-6.
44. Ip B, Jones M, Bassett P, et al. Factors affecting the healing of the perineum following surgery. Ann R Coll Surg Engl 2013;95:252-7.
45. El-Gazzaz G, Hull T, Church JM. Biological immunomodulators improve the healing rate in surgically treated perianal Crohn's fistulas. Colorectal Dis 2012;14:1217-23.
46. Figg RE, Church JM. Perineal Crohn's disease: an indicator of poor prognosis and potential proctectomy. Dis Colon Rectum 2009;52:646-50.
47. Pellino G, Selvaggi F. Surgical treatment of perianal fistulizing Crohn's disease: from lay-open to cell-based therapy--an overview. ScientificWorldJournal 2014;2014:146281.
48. Sandborn WJ, Fazio VW, Feagan BG, et al. AGA technical review on perianal Crohn's disease. Gastroenterology 2003;125:1508-30.
49. Wiese DM, Schwartz DA. Managing Perianal Crohn's Disease. Curr Gastroenterol Rep 2012;14:153-61.
50. Church J. Missing the Boat? Appreciating the Importance of the Pathophysiology of Perianal Crohn's Disease in Guiding Biological and Surgical Therapy. Dis Colon Rectum 2018;61:529-531.
51. Yassin NA, Askari A, Warusavitarne J, et al. Systematic review: the combined surgical and medical treatment of fistulising perianal Crohn's disease. Aliment Pharmacol Ther 2014;40:741-9.
52. Vermeire S, Van Assche G, Rutgeerts P. Perianal Crohn's disease: classification and clinical evaluation. Dig Liver Dis 2007;39:959-62.
53. Lee MJ, Heywood N, Sagar PM, et al. Association of Coloproctology of Great Britain and Ireland consensus exercise on surgical management of fistulating perianal Crohn's disease. Colorectal Dis 2017;19:418-429.
54. Regueiro M, Mardini H. Treatment of perianal fistulizing Crohn's disease with infliximab alone or as an adjunct to exam under anesthesia with seton placement. Inflamm Bowel Dis 2003;9:98-103.
55. Hyder SA, Travis SP, Jewell DP, et al. Fistulating anal Crohn's disease: results of combined surgical and infliximab treatment. Dis Colon Rectum 2006;49:1837-41.
56. Visscher AP, Felt-Bersma RJ. Endoanal ultrasound in perianal fistulae and abscesses. Ultrasound Q 2015;31:130-7.
57. Williamson PR, Hellinger MD, Larach SW, et al. Twenty-year review of the surgical management of perianal Crohn's disease. Dis Colon Rectum 1995;38:389-92.
58. Faucheron JL, Saint-Marc O, Guibert L, et al. Long-term seton drainage for high anal fistulas in Crohn's disease--a sphincter-saving operation? Dis Colon Rectum 1996;39:208-11.
59. Sugita A, Koganei K, Harada H, et al. Surgery for Crohn's anal fistulas. J Gastroenterol 1995;30 Suppl 8:143-6.
60. van der Hagen SJ, Baeten CG, Soeters PB, et al. Staged mucosal advancement flap for the treatment of complex anal fistulas: pretreatment with noncutting Setons and in case of recurrent multiple abscesses a diverting stoma. Colorectal Dis 2005;7:513-8.
61. Williams JG, MacLeod CA, Rothenberger DA, et al. Seton treatment of high anal fistulae. Br J Surg 1991;78:1159-61.
62. Schwartz DA, White CM, Wise PE, et al. Use of endoscopic ultrasound to guide combination medical and surgical therapy for patients with Crohn's perianal fistulas. Inflamm Bowel Dis 2005;11:727-32.
63. Morrison JG, Gathright JB, Jr., Ray JE, et al. Surgical management of anorectal fistulas in Crohn's disease. Dis Colon Rectum 1989;32:492-6.
64. Scott HJ, Northover JM. Evaluation of surgery for perianal Crohn's fistulas. Dis Colon Rectum 1996;39:1039-43.
65. Sangwan YP, Rosen L, Riether RD, et al. Is simple fistula-in-ano simple? Dis Colon Rectum 1994;37:885-9.
66. Soltani A, Kaiser AM. Endorectal advancement flap for cryptoglandular or Crohn's fistula-in-ano. Dis Colon Rectum 2010;53:486-95.
67. Mizrahi N, Wexner SD, Zmora O, et al. Endorectal advancement flap: are there predictors of failure? Dis Colon Rectum 2002;45:1616-21.
68. Lindsey I, Smilgin-Humphreys MM, Cunningham C, et al. A randomized, controlled trial of fibrin glue vs. conventional treatment for anal fistula. Dis Colon Rectum 2002;45:1608-15.
69. Grimaud JC, Munoz-Bongrand N, Siproudhis L, et al. Fibrin glue is effective healing perianal fistulas in patients with Crohn's disease. Gastroenterology 2010;138:2275-81, 2281.e1.
70. Senejoux A, Siproudhis L, Abramowitz L, et al. Fistula Plug in Fistulising Ano-Perineal Crohn's Disease: a Randomised Controlled Trial. J Crohns Colitis 2016;10:141-8.
71. Prosst RL, Joos AK. Short-term outcomes of a novel endoscopic clipping device for closure of the internal opening in 100 anorectal fistulas. Tech Coloproctol 2016;20:753-758.
72. Nordholm-Carstensen A, Krarup PM, Hagen K. Treatment of Complex Fistula-in-Ano With a Nitinol Proctology Clip. Dis Colon Rectum 2017;60:723-728.
73. Gautier M, Godeberge P, Ganansia R, et al. Easy clip to treat anal fistula tracts: a word of caution. Int J Colorectal Dis 2015;30:621-4.
74. Mennigen R, Laukotter M, Senninger N, et al. The OTSC((R)) proctology clip system for the closure of refractory anal fistulas. Tech Coloproctol 2015;19:241-6.
75. Kaminski JP, Zaghiyan K, Fleshner P. Increasing experience of ligation of the intersphincteric fistula tract for patients with Crohn's disease: what have we learned? Colorectal Dis 2017;19:750-755.
76. Wilhelm A, Fiebig A, Krawczak M. Five years of experience with the FiLaC laser for fistula-in-ano management: long-term follow-up from a single institution. Tech Coloproctol 2017;21:269-276.
77. Gu J, Valente MA, Remzi FH, et al. Factors affecting the fate of faecal diversion in patients with perianal Crohn's disease. Colorectal Dis 2015;17:66-72.
78. Yamamoto T, Allan RN, Keighley MR. Audit of single-stage proctocolectomy for Crohn's disease: postoperative complications and recurrence. Dis Colon Rectum 2000;43:249-56.
79. Kasparek MS, Glatzle J, Temeltcheva T, et al. Long-term quality of life in patients with Crohn's disease and perianal fistulas: influence of fecal diversion. Dis Colon Rectum 2007;50:2067-74.
80. Edwards CM, George BD, Jewell DP, et al. Role of a defunctioning stoma in the management of large bowel Crohn's disease. Br J Surg 2000;87:1063-6.
81. Post S, Herfarth C, Schumacher H, et al. Experience with ileostomy and colostomy in Crohn's disease. Br J Surg 1995;82:1629-33.
82. Galandiuk S, Kimberling J, Al-Mishlab TG, et al. Perianal Crohn disease: predictors of need for permanent diversion. Ann Surg 2005;241:796-801; discussion 801-2.
83. Schaden D, Schauer G, Haas F, et al. Myocutaneous flaps and proctocolectomy in severe perianal Crohn's disease--a single stage procedure. Int J Colorectal Dis 2007;22:1453-7.
84. Marks PW, Witten CM, Califf RM. Clarifying Stem-Cell Therapy's Benefits and Risks. N Engl J Med 2017;376:1007-1009.
85. Al-Maawali AK, Nguyen P, Phang PT. Modern Treatments and Stem Cell Therapies for Perianal Crohn's Fistulas. Can J Gastroenterol Hepatol 2016;2016:1651570.
86. Garcia-Olmo D, Garcia-Arranz M, Herreros D, et al. A phase I clinical trial of the treatment of Crohn's fistula by adipose mesenchymal stem cell transplantation. Dis Colon Rectum 2005;48:1416-23.
87. Garcia-Olmo D, Herreros D, Pascual I, et al. Expanded adipose-derived stem cells for the treatment of complex perianal fistula: a phase II clinical trial. Dis Colon Rectum 2009;52:79-86.
88. Cho YB, Lee WY, Park KJ, et al. Autologous adipose tissue-derived stem cells for the treatment of Crohn's fistula: a phase I clinical study. Cell Transplant 2013;22:279-85.
89. Lee WY, Park KJ, Cho YB, et al. Autologous adipose tissue-derived stem cells treatment demonstrated favorable and sustainable therapeutic effect for Crohn's fistula. Stem Cells 2013;31:2575-81.
90. de la Portilla F, Alba F, Garcia-Olmo D, et al. Expanded allogeneic adipose-derived stem cells (eASCs) for the treatment of complex perianal fistula in Crohn's disease: results from a multicenter phase I/IIa clinical trial. Int J Colorectal Dis 2013;28:313-23.
91. Park KJ, Ryoo SB, Kim JS, et al. Allogeneic adipose-derived stem cells for the treatment of perianal fistula in Crohn's disease: a pilot clinical trial. Colorectal Dis 2016;18:468-76.
92. Panes J, Garcia-Olmo D, Van Assche G, et al. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fistulas in Crohn's disease: a phase 3 randomised, double-blind controlled trial. Lancet 2016;388:1281-90.
93. Naldini G, Sturiale A, Fabiani B, et al. Micro-fragmented adipose tissue injection for the treatment of complex anal fistula: a pilot study accessing safety and feasibility. Tech Coloproctol 2018;22:107-113.
94. Norderval S, Lundby L, Hougaard H, et al. Efficacy of autologous fat graft injection in the treatment of anovaginal fistulas. Tech Coloproctol 2018;22:45-51.
95. Molendijk I, Nuij VJ, van der Meulen-de Jong AE, et al. Disappointing durable remission rates in complex Crohn's disease fistula. Inflamm Bowel Dis 2014;20:2022-8.
96. Bouguen G, Siproudhis L, Gizard E, et al. Long-term outcome of perianal fistulizing Crohn's disease treated with infliximab. Clin Gastroenterol Hepatol 2013;11:975-81.e1-4.
97. Gecse KB, Bemelman W, Kamm MA, et al. A global consensus on the classification, diagnosis and multidisciplinary treatment of perianal fistulising Crohn's disease. Gut 2014;63:1381-92.
98. Gaertner WB, Madoff RD, Spencer MP, et al. Results of combined medical and surgical treatment of recto-vaginal fistula in Crohn's disease. Colorectal Dis 2011;13:678-83.
99. Topstad DR, Panaccione R, Heine JA, et al. Combined seton placement, infliximab infusion, and maintenance immunosuppressives improve healing rate in fistulizing anorectal Crohn's disease: a single center experience. Dis Colon Rectum 2003;46:577-83.
100. van der Hagen SJ, Baeten CG, Soeters PB, et al. Anti-TNF-alpha (infliximab) used as induction treatment in case of active proctitis in a multistep strategy followed by definitive surgery of complex anal fistulas in Crohn's disease: a preliminary report. Dis Colon Rectum 2005;48:758-67.
101. Berry SM, Fischer JE. Enterocutaneous fistulas. Curr Probl Surg 1994;31:469-566.
102. Tassiopoulos AK, Baum G, Halverson JD. Small bowel fistulas. Surg Clin North Am 1996;76:1175-81.
103. Campos AC, Meguid MM, Coelho JC. Factors influencing outcome in patients with gastrointestinal fistula. Surg Clin North Am 1996;76:1191-8.
104. Fazio VW, Coutsoftides T, Steiger E. Factors influencing the outcome of treatment of small bowel cutaneous fistula. World J Surg 1983;7:481-8.
105. Givel JC, Hawker P, Allan R, et al. Entero-enteric fistula complicating Crohn's disease. J Clin Gastroenterol 1983;5:321-3.
106. Tonelli F, Ficari F. Pathological features of Crohn's disease determining perforation. J Clin Gastroenterol 1991;13:226-30.
107. Schwartz DA, Maltz BE. Treatment of fistulizing inflammatory bowel disease. Med Clin North Am 2010;94:19-34.
108. Heyen F, Winslet MC, Andrews H, et al. Vaginal fistulas in Crohn's disease. Dis Colon Rectum 1989;32:379-83.
109. Singh B, Mc CMNJ, Jewell DP, et al. Perianal Crohn's disease. Br J Surg 2004;91:801-14.
110. Hellers G, Bergstrand O, Ewerth S, et al. Occurrence and outcome after primary treatment of anal fistulae in Crohn's disease. Gut 1980;21:525-7.
111. Jones IT, Fazio VW, Jagelman DG. The use of transanal rectal advancement flaps in the management of fistulas involving the anorectum. Dis Colon Rectum 1987;30:919-23.
112. Joo JS, Weiss EG, Nogueras JJ, et al. Endorectal advancement flap in perianal Crohn's disease. Am Surg 1998;64:147-50.
113. Ruffolo C, Scarpa M, Bassi N, et al. A systematic review on advancement flaps for rectovaginal fistula in Crohn's disease: transrectal vs transvaginal approach. Colorectal Dis 2010;12:1183-91.
114. Michelassi F, Stella M, Balestracci T, et al. Incidence, diagnosis, and treatment of enteric and colorectal fistulae in patients with Crohn's disease. Ann Surg 1993;218:660-6.
115. Gruner JS, Sehon JK, Johnson LW. Diagnosis and management of enterovesical fistulas in patients with Crohn's disease. Am Surg 2002;68:714-9.
116. Yamamoto T, Keighley MR. Enterovesical fistulas complicating Crohn's disease: clinicopathological features and management. Int J Colorectal Dis 2000;15:211-5; discussion 216-7.
117. Daniels IR, Bekdash B, Scott HJ, et al. Diagnostic lessons learnt from a series of enterovesical fistulae. Colorectal Dis 2002;4:459-62.
