Guideline
| Download guideline |  |
 |
5-ASA/sulfasalazin
- Brug af 5-ASA under graviditet anses for at være sikker. Der er ikke rapporteret signifikant øget risiko for misdannelser, dødfødsler, spontan abort eller præterm fødsel.
- Der anbefales folinsyre-tilskud under behandling med sulfasalazin med henblik på at forebygge neuralrørsdefekt.
- 5-ASA kan anvendes under amning.
Corticosteroider
- Brug af corticosteroider under graviditet og amning anses for at være sikker.
- Budesonid kan anvendes under graviditet og amning.
Antibiotika
- Metronidazol og ciprofloxacin kan anvendes i korte kure under graviditet såvel som i ammeperioden.
Thiopuriner (Azathioprin, Purinethol)
- Det anses for sikkert at fortsætte igangværende remissionsbevarende behandling med thiopuriner.
- Opstart af remissionsbevarende behandling med thiopuriner til gravide, som ikke tidligere har fået behandling bør vurderes individuelt, pga. risiko for alvorlige bivirkninger, som pancreatitis og knoglemarvssuppression hos den gravide.
- Påbegyndelse af behandling er ikke relevant i 3. trimester, grundet tid til klinisk effekt.
- Det anses for sikkert at amme under thiopurinbehandling.
Methotrexat
- Behandling med methotrexat er kontraindiceret under graviditet og amning.
Anti-TNF (omfatter infliximab, adalimumab, certolizumab og golimumab)
- Behandling med anti-TNF anses for sikker under graviditet.
- Behandling med infliximab, adalimumab og golimumab i tredje trimester kræver individuel vurdering.
- Anti-TNF kan anvendes i forbindelse med amning.
Anti-integrin (omfatter natalizumab og vedolizumab)
- Data er ikke tilstrækkelige til at danne grundlag for kliniske anbefalinger under graviditet eller amning.
Anti-IL-12 & anti-IL-23 (omfatter ustekinumab)
- Data er ikke tilstrækkelige til at danne grundlag for kliniske anbefalinger under graviditet eller amning.
Ciclosporin
- Kun få data, men kan formentlig anvendes. Der er ikke rapporteret misdannelser.
- Amning må frarådes.
Generelle forholdsregler og information til patienten
- Remissionsbevarende behandling anbefales fortsat under graviditet og amning.
- Graviditet tilrådes, når sygdommen er i remission.
- Normal vitamin- og mineralstatus bør sikres.
- Ved aktiv sygdom følges de vanlige behandlingsprincipper.
- Regelmæssig obstetrisk vurdering vedr. fostertilvækst og -udvikling.
- Rygestop anbefales.
- Undersøgelser, som kan foretages under graviditet: endoskopi med forsigtighed, dog er kapselenteroskopi kontraindiceret pga. risiko for fastsiddende kapsel. UL-undersøgelse kan anvendes, mens øvrige billeddiagnostiske undersøgelser foretages afhængig af tidspunkt i graviditet samt indikation.
- Tæt samarbejde mellem gastroenterolog, obstetriker og eventuelt kirurg anbefales.
Børn født af mødre, som har modtaget anti-TNF behandling under graviditeten må ikke vaccineres med levende svækkede vacciner indenfor de første 12 måneder, med mindre der er påvist umålelige koncentrationer af lægemidlet i barnet. Den første levende svækkede vaccine (MFR) i det danske børnevaccinationsprogram gives, når barnet er 15 måneder gammel. Børnene kan således følge det danske børnevaccinationsprogram
Indledning
Baggrund
Eosinofil øsofagitis (EoE) er en kronisk immun-/antigenmedieret sygdom begrænset til øsofagus og karakteriseret ved øsofagusdysfunktion og eosinofil granulocyt-penetration i øsofagusslimhindens pladeepitel1,2. Incidensen af EoE er i Danmark tyvedoblet på 15 år (fra 0,13/100.000 i 1997 til 2,6/100.000 i 2012)3. En stor del af incidensstigningen må tilskrives stigende opmærksomhed hos klinikere og patologer. Hvorvidt der også er tale om en reel stigning i forekomsten af EoE kan kun vurderes, hvis der i en længere periode foretages en omhyggelig og standardiseret registrering af øsofaguseosinofili og symptomer, der kan relateres til EoE, samt behandlingeffekt heraf. Siden 2014 har EoE haft en selvstændig diagnosekode K20.9D. EoE er formentlig fortsat underdiagnosticeret, da øsofagus ofte vurderes normal ved gastroskopi. EoE er en kronisk tilstand, som recidiverer ved seponering af medicinsk eller diætetisk behandling og efter dilatation3. EoE er godartet og medfører ikke øget risiko for esophaguscancer, eosinofil leukæmi, hypereosinofili sydrom eller eosinofil gastroenterit4. Der er tiltagende evidens for, at varigheden af ubehandlet EoE er stærkt associeret med udvikling af fibrostenoser i esofagus5. Da sygdommen er ny, er evidensen stadig sparsom og guideline må forventes at ændres inden for en kort årrække.
Definition af eosinofil øsofagitis (EoE)
Eosinofil øsofagitis er en kronisk, immun/antigenmedieret øsofagussygdom karakteriseret klinisk af symptomer relateret til dysfunktion af øsofagus og histologisk af eosinofil inflammation. Der er ingen patognomoniske kliniske fund ved EoE.
Definitionen af EoE er fastlagt af en international konsensusgruppe i 20071 og modificeret til sin nuværende form af en international konsensusgruppe i 20116.
Definition af PPI responsiv øsofagus eosinofili (PPI-REE)
PPI-REE er defineret ved symptomer foreneligt med EoE og fuldt symptomatisk og histologisk respons på protonpummehæmmer (PPI) behandling. Det er uklart, om patienter med PPI-REE repræsenterer en (tidlig) variant af EoE, en helt selvstændig sygdomsgruppe eller en gruppe med atypisk GERD.
Hvordan stilles diagnosen EoE?
Hvordan diagnosen EoE stilles er fastsat af internationale konsensusgrupper og publiceret i 20071 med modifikationer i 20116. American College of Gastroenterology (ACG) har tilføjet deres EoE guidelines i 20135.
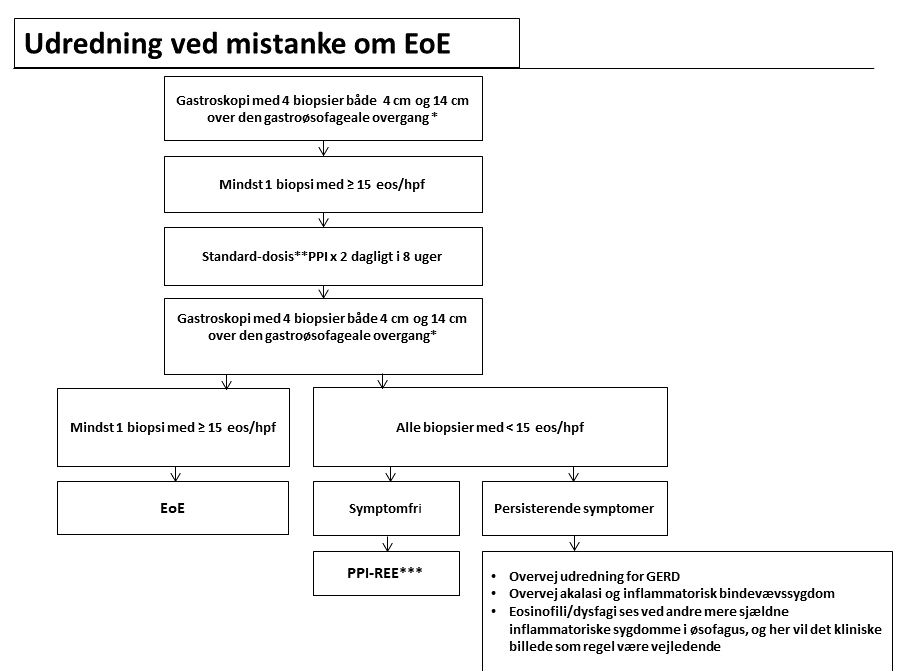
Udredningsalgoritme
Symptomer
EoE skal mistænkes ved symptomer på øsofagusdysfunktion f.eks.1) dysfagi, 2) fastsiddende fødebolus 3) reflukssymptomer 4) øsofagussmerter og 5) ændrede spisemønstre som respons på langsomt udviklet dysfagi, typisk langsom spisning eller stort indtag af væske til måltider.
Endoskopiske fund
De endoskopiske forandringer findes ved nøje inspektion hos over 80 %8. Et systematisk klassifikations- og graderingssystem er beskrevet og valideret9,10. Der er fundet acceptabel til god overensstemmelse for længdegående furer, hvide eksudater, ødem, multiringe og lumenforsnævring. Furer, eksudater og ødem er karakteristiske for akut inflammation. Multiringe og lumenforsnævring er ofte udtryk for remodellering og fibrose11. Det endoskopiske fund med multiple ringe kan ligne trachea og kan benævnes trachealisering. Længdegående rifter i den vulnerable slimhinde opstår let ved endoskopisk traumatisering.
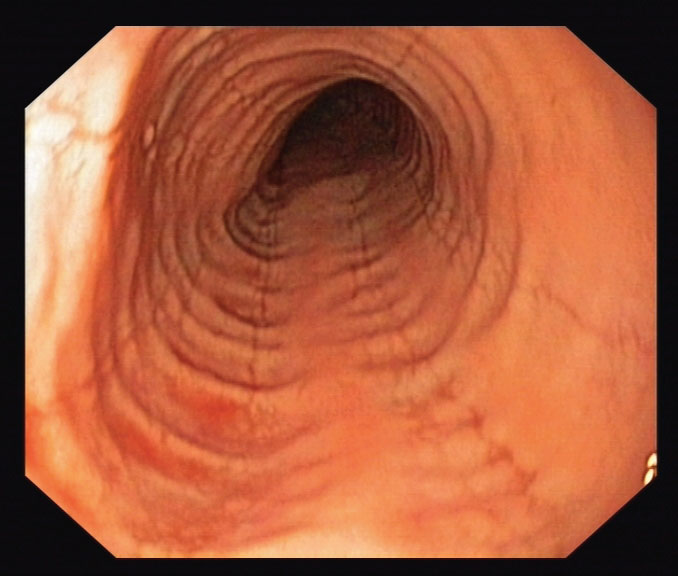
De makroskopiske fund er hverken specifikke eller sensitive nok til at stille diagnosen, og biopsier er derfor nødvendige. Inflammationen er ikke jævnt udbredt og for at undgå prøvevariationsfejl er multiple biopsier derfor et krav. Der er varierende holdninger til, hvor mange biopsier, der skal tages, og hvor de skal tages. En sensitivitet på tæt ved 100% er opnået med 6-9 biopsier i 2-3 niveauer12-14. Som en pragmatisk, memoteknisk tilgang anbefales 4 biopsier i hhv. 4 og 14 cm’s højde over den gastroøsofageale overgang2.
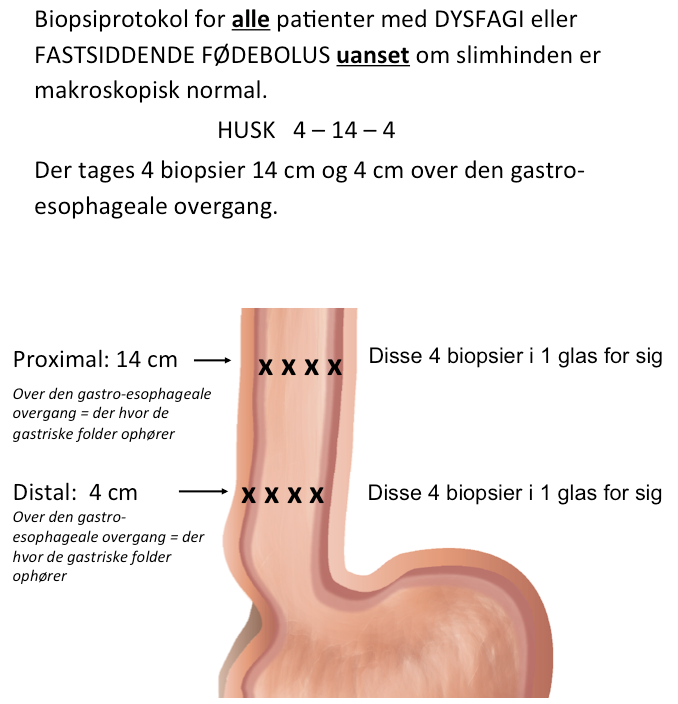
Patologi
Esophaguseosinofili er i konsensusartikler empirisk defineret som mindst 15 eosinofile i et enkelt high power field, idet denne værdi har vist sig at have den højeste positive og negative prædiktive værdi15. Det absolutte antal eosinofile granulocytter i synsfeltet (x40, ~0,24 mm2) med den højeste koncentration rapporteres. Kun de intraepiteliale, kerneholdige eosinofile granulocytter skal medregnes. Lokalisationen i epitelet (profund vs. superficiel) har ingen betydning. Pladeepitelet udviser oftest basalcellehyperplasi og spongiose og i varierende omfang degranulering af eosinofile granulocytter samt eosinofile mikroabscesser (defineret som en gruppe på mindst 4 intraepiteliale eosinofile granulocytter), ligesom der i et mindre antal tilfælde i lamina propria kan identificeres fibrose. Forekomst af eosinofile mikroabscesser anses for specifikt for EoE, men i øvrigt bidrager ingen af de nævnte forandringer til den diagnostiske sensitivitet eller specificitet. EoE er en kombineret klinisk-patologisk diagnose.
Behandling med protonpumpehæmmer
Patienter med symptomer og histologi der tyder på EoE bør behandles med PPI i standarddosis x 2 dagligt i 8 uger og derefter kontrolleres klinisk, endoskopisk og histologisk for at udelukke PPI-REE. Årsagen er, at et ”manglende respons på PPI-behandling” indgår i de nuværende diagnostiske kriterier for EoE5,6.
Hos voksne patienter med symptomer og histologi foreneligt med EoE opnår 25-80 % klinisk effekt og 33-61 % histologisk remission på PPI behandling16. Disse patienter defineres som havende PPI-REE og ikke EoE. Responsraterne er primært opnået i prospektive og retrospektive opgørelser17-19 samt to randomiserede studier, hvor effekten af PPI blev undersøgt overfor fluticason20,21. Tilstedeværelsen af denne betydende gruppe af patienter med effekt af PPI er baggrunden for at foretage et behandlingsforsøg med PPI hos alle patienter med symptomer og histologi foreneligt med EoE.
Patienter med PPI-REE er ikke forskellige fra patienter med EoE i forhold til klinisk præsentation, endoskopiske forandringer eller molekylære karakteristika, hvilket tyder på, at PPI-REE og EoE kunne være forskellige spektre af samme sygdom. Rationalet for at behandle EoE eller PPI-REE med PPI er: 1) PPI virker i sig selv antiinflammatorisk, 2) PPI behandler evt. samtidigt tilstedeværende GERD og 3) PPI behandling fremmer genopbygning af øsofagus slimhindenss integritet hos patienter med PPI-REE5.
De eneste to RCT, hvor patienter med øsofagus eosinofili og symptomer på EoE behandles med PPI, benytter esomeprazol 40 mg*1 dagligt (N=15 og N=21)5,6. Effekten er et klinisk respons hos 25 - 33 % og et histologisk respons hos 33 %. I retrospektive og prospektive studier er der indtil nu set effekt af Rabeprazol 20 mg x 2, Pantoprazol 40 mg x 1 og Esomeprazol 40 mg x 2. Effekten af PPI behandling hos disse patienter varierer på grund af studiernes meget forskellige definitioner for respons. Generelt er studierne små.
Specifikke anvisninger om optimal dosis og varighed af PPI behandling findes der ingen evidens for.
Øvrig udredning
Der er ingen serologiske markører, der kan bruges til at diagnosticere eller til at følge udviklings- og behandlingsrespons hos patienter med EoE. Hos patienter mistænkt for EoE eller med sikker EoE diagnose kan det i nogle tilfælde være relevant at undersøge for:
GERD med 24-timers-pH-måling (hyppigt halsbrand og/eller regurgitation)
Akalasi med High Resolution impedance Manometri (HRiM) og røntgen af øsofagus (behandlingsresistent, endoskopiske tegn)
Andre komorbiditeter ved relevante symptomer (se udrednings flow chart)
Allergologisk udredning er kun relevant, hvis patienten er mistænkt for en af de hyppige allergiske komorbiditeter f.eks. astma, eksem, rhinit, fødevareallergi6.
Kliniske rekommendationer 1
- Patienter med dysfagi, fastsiddende fødebolus eller anden øsofagusdysfunktion (herunder ændret spisemønster) bør udredes (Niveau 2b)
- Diagnosen EoE stilles ud fra en samlet klinisk, endoskopisk og histologisk vurdering (Niveau 5)
- PPI-behandling er nødvendigt i udredningsfasen for at adskille PPI-REE og EoE. Der anbefales minimum 8 ugers behandling med PPI i standarddosis x 2 dagligt (Niveau 2b)
- Diagnosen PPI-REE stilles ved symptomer foreneligt med EoE og fuldt symptomatisk og histologisk respons på PPI behandling (Niveau 3b)
- Karakteristiske makroskopiske fund ses ved endoskopi hos over 80 % (Niveau 2b)
- Bioptering fra øsofagus foretages ca. 4 cm og ca. 14 cm oralt for Z-linien, og hvert sted tages 4 biopsier (Niveau 5)
- Øsofaguseosinofili er defineret som mindst 15 eosinofile i et enkelt high power field (Niveau 4)
- Ingen serologiske markører inkl. IgE kan bruges til at diagnosticere eller til at følge udviklings- eller behandlingsrespons (Niveau 3b)
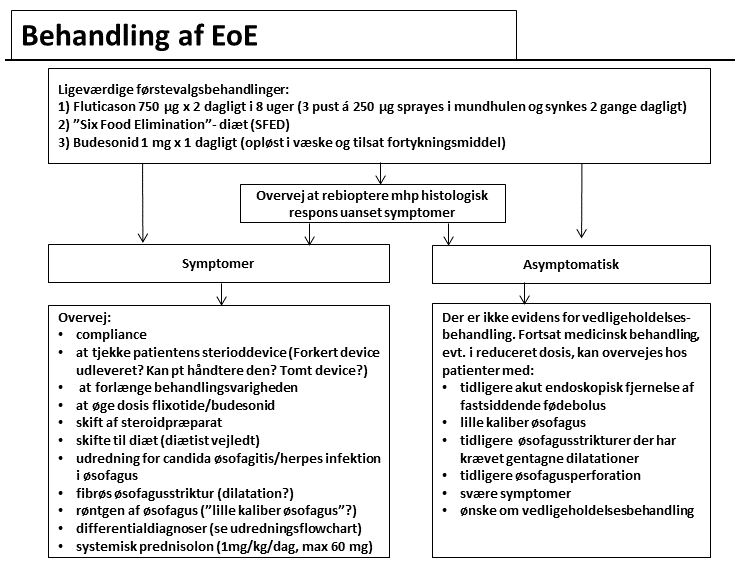
Hvordan behandles EoE?
Behandlingsalgoritme
Medicinsk behandling
Behandling med lokaltvirkende steroid
Der er aktuelt ingen præparater indregistreret til behandling af EoE. Lokalbehandling med steroid i øsofagus kan gives som:
- Fluticason der via en astmaspray sprøjtes ind i mundhulen og synkes
- Budesonid rørt op i væske med fortykningsmiddel der synkes
De fleste randomiserede studier er foretaget med børn og yngre voksne og viser signifikant histologisk og klinisk effekt af både fluticason og budesonid overfor placebo22,23. Hos voksne er der gennemført et enkelt randomiseret placebo-kontrolleret forsøg med fluticason, hvor komplet histologisk remission blev set hos 62 % i den aktivt behandlede gruppe mod 0% i placebogruppen, men ikke signifikant forskel i symptomatisk effekt (57 % vs 33 %)24. De anvendte doser varierer fra 880 til 1760 µg/dag og behandlingsvarigheden fra 6-12 uger. Effekten af opløst budesonid (1 mg dagligt i 15 dage) er i et enkelt studie undersøgt overfor placebo25 med signifikant bedre histologisk og klinisk respons i den aktivt behandlede gruppe. I internationale guidelines anbefales som første valg fluticason 440-880 µg x 2 dagligt i 8 uger5, idet budesonid er vanskeligere at administrere, da patienten selv skal varetage opløsning og sammenblanding med fortykningsmiddel.
Behandling med systemisk steroid
Effekten af systemisk steroid er kun undersøgt hos børn, hvor man i et enkelt kohortestudie fandt komplet histologisk resolution efter 4 ugers steroidbehandling26 og i et randomiseret studie fandtes bedre histologisk respons ved systemisk steroid sammenlignet med lokalbehandling med fluticason27. På grund af bivirkningsprofilen og de ofte gode resultater af lokalsteroidbehandling, anbefales systemisk steroid kun i nødstilfælde.
Behandling med andre medicingrupper
Følgende lægemidler anbefales ikke til behandling af EoE5:
- Leucotrienantagonister (Montelucast): Initiel effekt fra cases har ikke kunnet bekræftes i efterfølgende studier.
- Mastcelle stabilisatorer (Natriumcromoglicat): Har ikke vist effekt.
- Azathioprin (Imurel) og 6-mercaptopurin (Puri-Nethol): Kun 3 patienter behandlet forsøgsmæssigt. Ingen randomiserede forsøg. Klinisk effekt, men symptomerne kom igen efter seponering. Pga. toksiciteten anbefales disse præparater ikke.
- Biologisk behandling ((Mepolizumab (anti IL5), Reslizumab (anti-IL5), Omalizumab (anti-IgE) og Infliximab (anti-TNF)): Indtil videre ikke anbefalet behandling pga. små studier uden overbevisende klinisk effekt.
Endoskopisk behandling
Fastsiddende fødebolus bør fjernes med fleksibelt endoskop for at mindske risikoen for perforation. I et enkelt retrospektivt studie er perforationsrisikoen markant forøget ved brug af et stift skop i forhold til et fleksibelt (20% versus 0%)28.
Dilatation
Den kroniske eosinofile inflammation medfører remodellering og fibrose af de overfladiske lag i væggen29. Konsekvensen er generelt forsnævret lumen med nedsat distensibilitet og ikke sjældent lokaliserede fibrøse stenoser. Stenoser findes ved endoskopi, enten ved modstand mod passage af endoskopet eller iagttagelse af fikserede ringe. Den ofte lange tid fra symptomdebut til udredning medfører, at denne komplikation kan være til stede allerede ved diagnosetidspunktet. Indikation for primær dilatation er stenoser, som ikke tillader passage af standard gastroskop (10mm). Ved stenoser med diameter > 10 mm afgøres indikationen af det endoskopiske fund, en anamnese med fastsiddende fødebolus og manglende effekt af medicinsk behandling.
Dilatation foretages med endoskopisk placeret ballonkateter alternativt med dilatatorer over guidewire med røntgengennemlysning. Fordelene ved ballondilatation er, at det er nemmere at håndtere, at der er mulighed for at inspicere det dilaterede område umiddelbart efter proceduren, og at det også kan foretages uden røntgengennemlysning. Diameteren vælges efter endoskopifundet med en ballonstørrelse lige over den formodede diameter af stenosen. Der tilstræbes +3 mm i diameter i hver dilatationsseance og kun 1 mm ved hver oppustning af ballonen. Dvs. hvis diameteren på stenosen er 9 mm, dilateres til 10,11 og 12 mm konsekutivt og yderligere dilatation foretages ved ny procedure 4-8 uger senere. Hvis stenosen giver sig uden mucosalæsion, kan der dilateres 2-3 mm ekstra30,31.
Perforationsrisikoen ved dilatation blev i tidlige case serier rapporteret som forøget i forhold til peptiske stenoser. Senere analyser inklusiv en metaanalyse konkluderer, at den samlede risiko for blødning og perforation er omkring 0,1-0,2 %32-34. Risikofaktorer for perforation er meget snævre stenoser, lokalisation i midterste eller øvre del af øsofagus og måske anvendelse af dilatorer i forhold til balloner32. Mucosa-læsionerne efter dilatation er større end ved andre tilstande, hvilket skyldes den diffust udbredte subepiteliale fibrose og deraf følgende nedsatte elasticitet. Overfladiske mucosalæsioner med let blødning betragtes som det synlige bevis på effektiv dilatation35. Mere end halvdelen får retrosternale synkesmerter efter behandlingen, og det er således forventeligt og ikke at betragte som en komplikation i sig selv.
Diæt
Eliminationsdiæt
De fleste voksne med EoE kan blive symptomfrie ved at følge ”Six Food Elimination”-diæt (SFED). I denne diæt udelukkes hvede, æg, mælkeprodukter, soja, peanuts/nødder og fisk/skaldyr. Et systematisk review og en metaanalyse har gennemgået 33 studier omhandlende effekten af forskellige diætetiske interventioner for behandling af EoE. SFED var den mest effektfulde diætetiske behandling med histologisk respons (≤ 5 eos/hpf) hos 64 % og nedsat synkebesvær hos 94 % af patienterne36. Disse studier er baseret på algoritmer, der kræver endoskopisk kontrol med bioptering før start af diæt samt efter hver re-introduktion af to fødeemner i kosten medførende et minimum af 4 gastroskopier per patient og dermed svært at gennemføre i daglig klinisk praksis.
Elementarkost ledsages ligeledes af et højt histologisk respons (72 % har ≤10 eos/hpf). Prisen og diætens konsistens og smag gør elementarkost meget svær at gennemføre36,37. Eliminationsdiæt på baggrund af forudgående allergitestning har hos voksne vist betydeligt lavere histologiske responsrater end SFED, 27-35 %.
En spansk gruppe har udviklet en ”four food eliminations”-diæt, som er afprøvet i et prospektivt multicenter kohortestudie med en klinisk-patologisk responsrate på 54 %38. I denne diæt udelukkes mælkeprodukter, hvede, æg og bælgfrugter.
En symptombaseret tilgang til SFED er i brug i Danmark. Eliminationsdiæten styres ud fra symptomer og ikke ud fra biopsier. Den er mest anvendelig hos patienter med hyppige symptomer.
Ved SFED udelukkes proteiner fra mælkeprodukter, soja, æg, hvede, peanuts/nødder og fisk/skaldyr fra kosten39. Diæten er meget omfattende og kræver god compliance for effekt. Efter en eliminationsperiode på seks uger, introduceres hver fødevaregruppe enkeltvis med to ugers mellemrum37. Rækkefølgen af fødevaregruppernes genindførsel kan være individuel. Såfremt der ikke opstår symptomer ved reintroduktion af en fødevaregruppe, fortsættes indtaget hvorefter næste fødevaregruppe kan reintroduceres to uger senere. Oplever patienten symptomer, vejledes der i at gå tilbage til den fulde eliminationsdiæt i to uger indtil patienten atter er symptomfri, hvorefter næste fødevaregruppe kan indføres37. Undersøgelser viser, at flere og ikke kun én fødevaregruppe kan give symptomer39,40.
Den første samtale, hvor patienten introduceres til diæten, er meget omfattende, og kræver en grundig vejledning. Patienten skal have en forståelse for og vejledning i sammensætningen af kosten, samt skal vejledes i at læse varedeklarationer. Det er vigtigt, at kosten er sammensat således, at anbefalingerne for makro- og mikronæringsstoffer opfyldes. Da der i eliminationsperioden er risiko for ensidig kost, anbefales et dagligt tilskud af en multivitamintablet, samt kalk og D-vitamin.
Opfølgning anbefales inden for de første to uger efter start på eliminationsdiæten, hvor patienten forinden har kostregistreret for tre dage som dokumentation af forståelsen for diæten samt for at udelukke eventulle kontaminationer af fødeemner39. Herefter anbefales opfølgning hver anden uge inden introduktion af ny fødevaregruppe samt kontrolgastroskopi med biopsier, når patientens eliminationskost er afklaret for at sikre, at der også er histologisk effekt.
Kliniske rekommendationer 2
- Lokalbehandling med steroid er førstevalgsbehandling, f.eks. fluticason 750 µg x 2 dagligt. i 8 uger (Niveau 1b)
- Fastsiddende fødebolus bør fjernes med fleksibelt gastroskop (Niveau 4)
- Ved symptomgivende fibrøs stenose er der indikation for dilatation (Niveau 4)
- Perforation og blødning er sjældne komplikationer (0,1-0,2 %) ved dilatation. Mere end halvdelen får retrosternale synkesmerter (Niveau 2a)
- ”Six food elimination”-diæt er en effektiv behandling. Kræver dedikeret klinisk diætist (Niveau 2b)
- Allergologisk testning forud for valg af diæt er ikke effektivt (Niveau 2b)
Hvad er behandlingsmålet for EoE?
Det ideelle mål er komplet symptomlindring og elimination af alle eosinofile granulocytter i øsofagusepitelet. Histologisk remission antages at forhindre komplikationer til vedvarende inflammation som stenoser og for lille øsofaguskaliber. Histologisk respons er i nogle studier defineret som totalt fravær af eosinofile granulocytter i biopsier25, i andre anvendes blot en reduktion i antallet som udtryk for behandlingseffekt41. Der er ikke altid overensstemmelse mellem symptomatisk og histologisk respons42, hvorfor kontrol af behandlingseffekt optimalt omfatter fornyet bioptering. Det ideelle behandlingsmål kan være vanskeligt at opnå, og man må ofte nøjes med en betydelig reduktion af inflammationen og symptomerne5.
Kliniske rekommendationer 3
- Behandlingsmålet er både en markant reduktion af kliniske symptomer og af den eosinofile inflammation (Niveau 5).
- Da behandlingseffekt på symptomer ikke altid afspejler histologisk respons, kan det overvejes at rebioptere efter start på nyt behandlingsprincip (Niveau 5).
Den videre behandling og opfølgning af patienter med EoE eller PPI-REE
Der foreligger ingen studier af hvilke patienter, der vil have gavn af vedligeholdelsesbehandling.
Der er lavet et RCT af langtidsbehandling af voksne med EoE (N = 28), med 1 mg budesonid versus placebo i 50 uger. Der var ingen histologisk effekt 43.
Det anbefales i de amerikanske ACG EoE guidelines, at man trods den manglende evidens på området overvejer vedligeholdelsesterapi hos nedenstående patientgrupper5:
- tidligere akut endoskopisk fjernelse af fastsiddende fødebolus
- lille kaliber øsofagus
- tidligere strikturer der har krævet gentagne dilatationer
- tidligere øsofagusperforation
- svære symptomer
- patienten ønsker det
Argumentet for denne strategi er, at retrospektive studier tyder på, at risikoen for at udvikle øsofagusstrikturer og lange øsofagusstenoser (”narrow caliber esophagus”) korrelerer stærkt med varigheden af symptomer hos EoE patienter før behandling initieres og formodentligt dermed også med graden af inflammation5. Da ovennævnte patientgrupper enten har fibrostenoser eller menes at være i høj risiko for at udvikle dem, giver det mening af forsøge at dæmpe inflammationen for at forhindre eller bremse fibroseudviklingen.
Det er også uvist, hvordan patienter med PPI-REE bedst følges. Internationale ekspertgrupper anbefaler at udrede for GERD, fortsætte PPI-behandling og fortsætte kliniske kontroller hos PPI-REE patienter.
Der er i litteraturen case-rapporter, hvor PPI-REE med tiden udvikler sig til regelret EoE16,44.
Kliniske rekommendationer 4
- Der er endnu ingen dokumenteret effekt af vedligeholdelsesbehandling for EoE (Niveau 2b).
- Man bør overveje vedligeholdelsesterapi ved stor risiko for udvikling af stenoser (Niveau 5).
Behandlingssvigt eller manglende sammenhæng mellem symptomer og histologi
I flow chartet for behandling af EoE er hyppige årsager til behandlingssvigt opsummeret, og der er givet forslag til videre behandling ud fra publicerede caseserier og kohortestudier. Der er publiceret effekt af at øge steroiddosis, at skifte steroidpræparat, men oftest ses behandlingssvigt pga. compliance-problemer, eller fordi patienten har fået udleveret et device med fluticason, der kun udløses ved inhalation. Derudover er der talrige eksempler i litteraturen på cases, hvor histologi og symptomer ikke følges ad. Overvej i disse situationer altid, om der er tilkommet fibrøs øsofagusstriktur og om patienten har en af differentialdiagnoserne33.
Klinisk rekommendation 5
- Der er ingen studier af EoE patienter med behandlingssvigt på lokalsteroidbehandling. Forslag til strategi ud fra casestudier er summeret i Quick Guidens behandlingsalgoritme (Niveau 4).
Forfattere og korrespondance
Sabine Becker, Lisbet Ambrosius Christensen (tovholder), Lone Larsen, Inge Nordgaard-Lassen; Mette Julsgaard; Klaus Theede, Benedicte Wilson
Korrespondance:
Korrespondance: Lisbet Ambrosius Christensen, Med. Afd. V, Århus Universitetshospital, e-mail: This email address is being protected from spambots. You need JavaScript enabled to view it.
Status
| Første udkast | jul 2011 |
| Diskuteret til Aarsmødet | sep 2011 |
| Korrigeret udkast | dec 2011 |
| Endelig guideline | jan 2012 |
| Revideret guideline | jun 2017 |
| Guideline skal revideres senest | jun 2021 |
Afgrænsning af emnet
Anbefalingerne vedrørende medicinsk behandling vil kun omfatte systemisk, og ikke lokal behandling. Anbefalinger om lokal behandling følger de systemiske medicinske behandlinger vedrørende præparater med identisk indhold. Almindelige behandlingsprincipper af moderat og svær sygdom vil ikke blive gennemgået, idet der henvises til øvrige guidelines. For en mere uddybende behandlingsstrategi af gravide henvises til andre internationale guidelines.1–4
Anbefalingerne inkluderer ikke overvejelser omkring fertilitet, sædkvalitet eller behandling af fædre med IBD.
Definitioner
Graviditetsudkomme omfatter hyppighed af større misdannelser, for tidlig fødsel (før 37. gestationsuge), lav fødselsvægt (under 2500 g) og reduceret fostervækst.
Forkortelser
IBD Inflammatory Bowel Disease
CD Crohns sygdom
UC Colitis ulcerosa
TPMT Thiopurin methyltransferase
FDA Food and Drug Administration
5-ASA 5-aminosalicylsyre
6-MP 6-mercaptopurin
Litteratur søgning
Litteratursøgning afsluttet dato: 01.03.2017.
Søgning i PubMed og The Cochrane Library. Søgeord: Inflammatory bowel disease, pregnancy, thiopurines, glucocorticoids, 5-ASA, infliximab, adalimumab, natalizuman, vedolizumab, methotrexate, ustekinumab, medical treatment, guidelines, antibiotics, outcome
Interessekonflikter
Ej udfyldt
References
1. Futura GT, Liacouras CA, Collins MH et al. Eosinophilic Esophagitis in Children and Adults: A Systematic Review and Consensus Recommendations for Diagnosis and Treatment. Gastroenterology 2007;133:1342-63
2. Krarup AL, Vyberg M, Ejstrud P. Eosinofil øsofagitis hos voksne. Ugeskr læger 2014;176:1755-
3. Dellon ES, Erichsen R, Baron JA et al. The Increasing Incidence and Prevalence of Eosinophilic esophagitis outpaces changes in endoscopic and biopsy practice: National Population-based estimates from Denmark (submitted to publication)
4. Akiyama J, Alexandre L, Baruah A et al. Strategy for prevention of cancers of the esophagus. Ann N Y Acad Sci 2014;1325:108-26
5. Dellon ES, Gonsalves N, Hirano I et al. ACG clinical guideline: Evidenced based approach to the diagnosis and management of esophageal eosinophilia and eosinophilic esophagitis (EoE). Am J Gastroenterol 2013;108:679-92
6. Liacouras CA, Futura GT, Hirano I et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol 2011;128:3-20
7. Guyatt GH, Oxman AD, Vist GE et al. GRADE: An emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008;336:924-6
8. Dellon ES. Do you see what I see? Towards standardized reporting of endoscopic findings in eosinophilic esophagitis. Endoscopy 2014;46:1043-5
9. Hirano I, Moy M, Heckman MG et al. Endoscopic assessment of the endoscopic features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut 2013;62:489-952
10. van Rhijn BD, Marijn JW, Wouter LC et al. Endoscopy 2014;46:1049-55
11. Aceves SS. Remodeling and fibrosis in chronic eosinophil inflammation. Dig Dis 2014;32:15-21
12. Peery AF, Cao H, Dominik R et al. Variable reliability of endoscopic findings with white-light and narrow-band imaging for patients with suspected eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:475–480
13. Shah A, Kagalwalla AF, Gonsalves N et al. Histopathologic variability in children with eosinophilic esophagitis. Am J Gastroenterol 2009;104:716–721
14. Bussmann C. Requirements of the Pathologist to the Endoscopist (Biopsy Sampling) Dig Dis 2014;32:74-7
15. Dellon ES, Speck O, Woodward K, Covey S, Rusin S, Shaheen NJ, Woosley JT. Distribution and variability of esophageal eosinophilia in patients undergoing upper endoscopy. Mod Pathol. 2014 Sep 12. doi: 10.1038/modpathol.2014.110. [Epub ahead of print] PubMed PMID: 25216228
16. Molina-Infante J, Katzka DA, Gisbert JP. Review article: proton pump inhibitor therapy for suspected esosinophilic oesophagitis. Aliment Pharmacol Ther 2013;37:1157-64
17. Molina-Infante J, Ferrando-Lamana L, Ripoll C et al. Esophageal eosinophilic infiltration responds to proton pump inhibition in most adults. Clin Gastroenterol Hepatol 2011;9:110-17
18. Francis DL, Foxx-Orenstein A, Arora AS et al. Aliment Pharmacol Ther 2012;35:300-7
19. Abe Y, Lijima K, Ohara S et al. J Gastroenterol 2011;46:25-30
20. Peterson KA, Thomas KL, Hilden K et al. Dig Dis Sci 2010;55:1313-9
21. Moawad FJ, Ganesh R, Johnny A et al. Randomized Controlled Trial Comparing Aerosolized Swallowed Fluticasone to Esomeprazole for Esophageal Eosinophilia. Am J Gastroenterol 2013;108:366-72
22. Butz BK, Wen T, Gleich GJ et al. Efficacy, dose reduction, and resistance to high-dose fluticasone in patients with eosinophilic esophagitis. Gastroenterology 2014;147:324-33
23. Dohil R, Newbury R, Fox L et al. Oral viscous budesonide is effective in children with eosinophilic esophagitis in a randomized, placebo-controlled trial. Gastroenterology 2010;139:418-29
24. Alexander JA, Jung KW, Arora AS et al. Swallowed fluticasone improves histologic but not symptomatic response of adults with esosinophilic esophagitis. Clin Gastroenterol Hepatol 2012;10:742-9
25. Straumann A, Conus S, Degen L et al. Budesonide is effective in adolescent and adult patients with active eosinophilic esophagitis. Gastroenterology 2010;139:1526-37
26. Liacouras CA, Spergel JM, Ruchelli E et al.Eosinophilic esophagitis: a 10-year experience in 381 children. Clin Gastroenterol Hepatol 2005;3:1198-206
27. Schaefer ET, Fitzgerald JF, Molleston JP et al. Comparison of oral prednisone and topical fluticasone in the treatment of eosinophilic esophagitis: a randomized trial in children. Clin Gastroenterol Hepatol 2008;6:165-73
28. Straumann, A, Bussmann C et al. Eosinophilic esophagitis: analysis of food impaction and perforation in 251 adolescent and adult patients. Clin Gastroenterol Hepatol 2008;6:598-600
29. Aceves SS. Remodeling and fibrosis in chronic eosinophil inflammation. Dig Dis 2014;32:15-21
30. Saligram S, McGrath K. The safety of a strict wire-guided dilation protocol for eosinophilic esophagitis. Eur J Gastroenterol Hepatol 2014;26:699-703
31. Schoepfer AM, Gonsalves N, Bussmann C et al. Esophageal dilation in eosinophilic esophagitis: effective ness, safety and impact on the underlying inflammation. Am J Gastroenterol 2010;105:1062-70
32. Jung KW, Gundersen N et al. Occurrence of and risk factors for complications after endoscopic dilatation in eosinophilic esophagitis. Gastrointestinal endoscop 2011;73:15-21
33. Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713-20
34. Schoepfer A. Treatment of eosinophilic esophagitis by dilation. Dig Dis 2014;32:130-3
35. Dellon ES, Liacouras CA. Advances in clinical management of eosinophilic esophagitis. Gastroenterology 2014;147:1238-54
36. Arias Á, González-Cervera J, Tenias JM et al. Efficacy of Dietary Interventions for Inducing Histologic Remission in Patients with Eosinophilic Esophagitis: A systematic Review and Meta-analysis. Gastroenterology 2014;146:1639-48
37. Peterson KA, Byrne KR, Vinson LA, et al. Elemental diet induces histologic responses in adult aosinophilic esophagitis. Am J Gastroenterol 2013; 108:759-66.
38. Molina-Infante J, Arias A, Barrio J et al. Four-food group elimination diet for adult eosinophilic esophagitis: A prospective multicenter study. J Allergy Clin Immunol 2014;134:1093-9
39. Gonsalves N, Guang-Yu Yang, Doerfler B et al. Elimination diet Effectively Treats Eosinophilic Esophagitis in Adults; Food Reintroduction Identifies Causative Factors, Gastroenterology 2012;142:1451-9
40. Lucendo AJ, Arias A, Gonzalez J et al. Empiric 6-food elimination diet induced and maintained prolonged remission in patients with adult eosinophilic esophagitis: A prospective study on the food cause of the disease. J Allergy Clin Immunol 2013;131:797-804
41. Kagalwalla AF, Sentongo TA, Ritz S et al. Effect of six-food elimination diet on clinical and histological outcomes in eosinophilic esophagitis. Clin Gastroenterol Hepatol 2006;4:1097-102
42. Hirano I. Therapeutic end points in eosinophilic esophagitis: is elimination of esophageal eosinophils enough? Clin Gastroenterol Hepatol 2012;10:750-2 (letter)
43. Straumann A, Conus S, Degen L et al. Long-term budesonide maintenance treatment is poartially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400-9
44. Dellon ES. Diagnosis and management of eosinophilic esophagitis. Clin Gastroenterol Hepatol 2012;10:1066-78